Het vorige deel laat zien hoe verschillende elementen ofwel op zichzelf kunnen bestaan ofwel met andere elementen kunnen combineren om verbindingen te maken. Dit deel bouwt voort op deze ideeën door meer in detail te kijken naar chemische reacties. Het laat ook zien hoe chemische steno kan worden uitgebreid tot het beschrijven van chemische reacties.
Bedenk eerst enkele van de eerder beschreven moleculen: water, methaan, kooldioxide en ammoniak.
Vraag 26
Wat zijn de formules voor elk van deze vier moleculen?
Antwoord
De formules zijn respectievelijk H2O, CH4, CO2 en NH3.
Hoewel u de chemische formules van de in deze cursus geïntroduceerde verbindingen niet hoeft te onthouden, zal het waarschijnlijk nuttig zijn er een paar te onthouden, zoals die voor de vier moleculen hierboven, plus die voor waterstofmoleculen (H2), stikstofmoleculen (N2) en zuurstofmoleculen (O2). Dit zal je helpen bij het lezen en schrijven van deze chemische formules zonder steeds terug te hoeven grijpen op vorige hoofdstukken.
Nu ga je kijken naar reacties waarbij de elementen waterstof, koolstof en zuurstof betrokken zijn en de verbindingen methaan, water en kooldioxide.
Waterstof reageert met zuurstof als het wordt aangestoken (het is nogal explosief) en vormt water. Om een dergelijke reactie in termen van een chemische vergelijking te schrijven, worden de stoffen die de reactie ondergaan, links gezet en de stoffen die bij de reactie ontstaan, rechts. De reactanten links worden met een pijl verbonden met de producten rechts.
De vergelijking kan worden geschreven als een woordvergelijking ‘waterstof en zuurstof maken water’ of, met een beetje chemische steno, als:

waarbij de pijl ‘gaat naar’ betekent.
Probeer nu de chemische steno te gebruiken om de vergelijking te schrijven. Substitutie van symbolen in de woordvergelijking geeft:

De vergelijking laat zien dat de reactanten links van de pijl worden omgezet in het product rechts. Er is echter iets mis met deze vergelijking. Je kunt zien wat er mis is door te kijken naar figuur 21 waar de reactanten en producten schematisch zijn weergegeven.
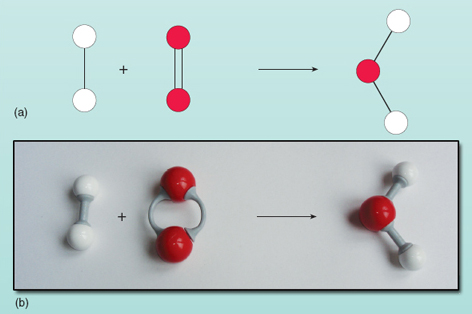
Telling van het aantal atomen aan elke kant van de vergelijking laat zien dat er twee zuurstofatomen aan de linkerkant zijn en één aan de rechterkant. Het aantal zuurstofatomen aan beide kanten van de vergelijking moet gelijk zijn – ze kunnen niet op magische wijze verschijnen en verdwijnen tijdens een reactie. Het is niet mogelijk om de samenstelling van het watermolecuul aan de rechterkant van de vergelijking te veranderen, omdat het watermolecuul bestaat als een groep van twee waterstofatomen en één zuurstofatoom die allemaal aan elkaar gebonden zijn. Elke zuurstofmolecule levert twee zuurstofatomen en zal dus altijd twee watermoleculen vormen, op voorwaarde dat er twee waterstofmoleculen (die elk een eenheid van twee atomen vormen) zijn om mee te reageren. Er zijn dus twee waterstofmoleculen en één zuurstofmolecuul nodig om twee watermoleculen te maken. De reactie wordt nauwkeurig weergegeven door:

Er zijn nu evenveel atomen van elk type aan beide kanten van de vergelijking: de chemische vergelijking is in evenwicht, zodat we nu de pijl door een gelijkheidsteken kunnen vervangen.
Een laatste aanpassing om te voorkomen dat de waterstofmoleculen aan de linkerkant van de vergelijking en de watermoleculen aan de rechterkant elkaar overlappen, is ze weer te geven door 2H2 in plaats van H2 + H2. De evenwichtige chemische vergelijking wordt dan:

Dit is schematisch weergegeven in figuur 22.

Chemische vergelijkingen geven op een zeer beknopte manier niet alleen aan welke atomen en moleculen met elkaar reageren om de producten te vormen, maar ook hoeveel van elk soort atoom en molecuul daarbij betrokken zijn. Het is belangrijk te onthouden dat het getal voor een molecule het aantal van die specifieke molecule betekent. Bijvoorbeeld 3H2O betekent drie moleculen water, dus in totaal zes waterstofatomen en drie zuurstofatomen.
Chemische vergelijkingen moeten in evenwicht zijn; het aantal atomen van elk type element aan beide kanten van de vergelijking moet gelijk zijn.
Je weet nu hoe je een chemische vergelijking moet ‘lezen’ of interpreteren – en hoe deze een chemisch proces weergeeft. Scheikundigen zijn echter ook zeer bedreven in het schrijven van chemische vergelijkingen als een vorm van steno om verschillende chemische processen of reacties te beschrijven. Het schrijven van chemische vergelijkingen is net als het schrijven in een vreemde taal – het vereist oefening om het vloeiend te leren. Alle wetenschappers in de dop moeten echter ergens beginnen en het onderstaande gedeelte laat zien hoe je dat doet aan de hand van een heel bekende chemische reactie. Als je wilt nagaan of je deze paragraaf moet bestuderen, probeer dan eerst vraag 20.