Heb je je ooit afgevraagd waarom glowsticks (zie fig. 1) nog steeds gloeien nadat je ze gebogen hebt? Of waarom die plastic sterren ’s nachts nog steeds gloeien nadat het licht is uitgedaan? Misschien hebt u dat niet. Maar of u zich die vragen nu wel of niet gesteld hebt, de volgende tekst geeft u hopelijk antwoorden en uitleg over de verschijnselen van gloeiende armbanden, glanzende kwallen, black light, en nog veel meer.

Figuur 1. Gloedstaafjes.
Luminescentie
In het algemeen wordt de gloed die bij alle bovengenoemde verschijnselen optreedt luminescentie genoemd. Luminescentie is energie die door een stof vrijkomt in de vorm van licht . Er kunnen verschillende soorten luminescentie worden onderscheiden:
- Een voorbeeld is chemiluminescentie. Bij sommige chemische reacties komt energie vrij in de vorm van licht. Dit gebeurt na het buigen van een gloeistaaf. Het is ook de reden voor het oplichten van dieren zoals kwallen of sommige micro-organismen. In dit geval wordt het bioluminescentie genoemd.
- Een andere soort is triboluminescentie. Deze kan worden waargenomen wanneer een zelfklevende enveloppe in volledige duisternis wordt geopend of wanneer plakband in een donkere kamer wordt uitgerold. Hierbij wordt mechanische energie in het systeem gebracht, die als activator voor de gloed dient.
- Blijkbaar de meest bekende soort luminescentie is de fotoluminescentie. Hierbij wordt energie geleverd door elektromagnetische straling, bijvoorbeeld door zonlicht of een ultraviolette lamp, zoals in sommige discotheken. Dit veroorzaakt verschijnselen zoals de voortdurende gloed van plastic sterren of de extreme helderheid van witte kleding onder blacklight. Men kan een onderscheid maken tussen fluorescentie en fosforescentie, hetgeen hieronder zal worden uitgelegd .
Wat is een Elektronisch Opgewekte Toestand?
In het algemeen zijn alle soorten luminescentie gebaseerd op zogenaamde fotofysische processen. Gewoonlijk worden moleculen zelf als fluorescerend beschreven. Dit is het geval met fluorescerende kleurstoffen zoals fluoresceïne of curcumine. Om de fotofysische processen te verklaren, moet men echter een kijkje nemen op een nog kleiner niveau dan het moleculaire.
Atomen van verschillende elementen hebben een verschillend aantal elektronen, verdeeld over verschillende schillen en banen. Elektronen zijn een soort elementaire deeltjes. Elektronische overgangen zijn verantwoordelijk voor luminescentie. Wanneer het systeem energie absorbeert, worden de elektronen geëxciteerd en in een hogere energetische toestand gebracht. Vóór de excitatie, in de grondtoestand, bevinden sommige elektronen zich in de zogenaamde HOMO (Highest Occupied Molecular Orbital). Nadat zij een aangeslagen toestand hebben bereikt, bevinden zij zich in de LUMO (Lowest Unoccupied Molecular Orbital) (zie fig. 2). Hoe dit precies in zijn werk gaat, zal worden uitgelegd aan de hand van fotoluminescentie als specifiek voorbeeld.

Figuur 2. Elektronische excitatie.
Verschillende energetische toestanden van een atoom of molecuul staan bekend als “energieniveaus”. Afhankelijk van het molecuul en het atoom, kunnen de elektronen slechts discrete energieniveaus bezetten aangezien de energie gekwantiseerd is, wat betekent dat energie slechts in bepaalde hoeveelheden kan worden geabsorbeerd en uitgezonden. Het verschil tussen twee niveaus kan worden berekend met vergelijking 1 (waarbij E2 het hogere energieniveau is en E1 het lagere).
(1) ΔE = E2-E1
Fotonen, deeltjes waaruit elektromagnetische straling of licht bestaat, moeten een bepaalde energiewaarde hebben om elektronen te kunnen exciteren. De energie van een foton kan worden berekend met vergelijking 2, waarbij h de constante van Planck is en ν de frequentie van het licht.
(2) Ephoton = hν
De benodigde excitatie-energie voor de elektronen is gelijk aan het verschil tussen de energieniveaus. Alleen licht met een bepaalde energie, en dienovereenkomstig met een bepaalde frequentie en golflengte, is in staat om elektronen op te wekken. Door de vergelijkingen 1 en 2 aan elkaar gelijk te stellen, en met behulp van vergelijking 3 (waarin c staat voor de snelheid van het licht), kunnen de benodigde frequentie en golflengte worden berekend (zie eq. 4) . In veel gevallen wordt UV-straling gebruikt voor excitatie.
(3) λ = c/ν
(4) ΔE = Ephoton ⇔ E2 – E1 = hν
ν = (E2 – E1)/h
λ = hc/(E2 – E1)
Deactivering van elektronisch geëxciteerde toestanden
Zulke elektronisch geëxciteerde toestanden zijn onstabiel. Elektronen vallen terug naar hun grondtoestanden. Tegelijkertijd komt de excitatie-energie weer vrij. Men maakt onderscheid tussen radiatieve en niet-radiatieve vervalprocessen. Meestal is het verval niet-radiatief, bijvoorbeeld door vibratierelaxatie, quenching met omringende moleculen, of interne conversie (IC) . Deze processen worden later in detail toegelicht.
Soms kan een radiatief verval optreden in de vorm van fluorescentie en fosforescentie. De energie wordt uitgezonden in de vorm van elektromagnetische straling of fotonen. Het uitgezonden licht heeft een langere golflengte en een lagere energie dan het geabsorbeerde licht, omdat een deel van de energie al is vrijgekomen in een niet-radiatief vervalproces. Dit is de reden dat een emissie in het zichtbare spectrum kan worden bereikt door excitatie met niet-zichtbare UV-straling. Deze verschuiving naar een langere golflengte wordt Stokes-verschuiving genoemd .
Vergelijking: Fluorescentie vs. Fosforescentie
Zowel fluorescentie als fosforescentie zijn spontane emissies van elektromagnetische straling. Het verschil is dat de gloed van fluorescentie ophoudt direct nadat de bron van exciterende straling is uitgeschakeld, terwijl bij fosforescentie een nagloei met een duur van fracties van seconden tot uren kan optreden.
Om de fotofysische processen achter beide verschijnselen te vergelijken, zijn er enkele feiten over elektronen die nuttig zijn om te begrijpen: Elektronen zijn deeltjes die een zogenaamde spin hebben en een spin-kwantumgetal. Dit kan twee verschillende waarden hebben, namelijk +1/2 of -1/2 . Dit getal is een eigenschap die we ons eigenlijk niet gemakkelijk kunnen voorstellen of beschrijven. Het wordt vaak vergeleken met een tol die ofwel met de klok mee ofwel tegen de klok in draait. Deze beschrijving is echter wiskundig noch natuurkundig helemaal juist. Twee elektronen in een enkele orbitaal van een atoom hebben antiparallelle spin, die wordt genoteerd als (↓) .
Fluorescentie
In het Jablonski diagram voor fluorescentie (zie fig. 3) is de singlet spin toestand S0 de grondtoestand van de elektronen, en S1 en S2 zijn singlet aangeslagen toestanden (de toestanden worden in deze tekst alleen als voorbeeld gebruikt en zijn niet noodzakelijkerwijs van toepassing op bepaalde atomen, moleculen, etc.). Binnen die toestanden zijn er verschillende energieniveaus. Hoe hoger het niveau, hoe meer energie een elektron bezit wanneer hij zich in dat niveau bevindt. In het geval van singlet toestanden hebben de elektronen antiparallelle spins.

Figuur 3. Jablonski-diagram voor fluorescentie.
De elektronen worden bijvoorbeeld vanuit de grondtoestand S0 opgetild naar een energieniveau van de tweede aangeslagen toestand S2, wanneer ze door elektromagnetische straling worden geëxciteerd. Nadat de excitatie is gestopt, blijven de elektronen slechts gedurende korte tijd (ca. 10-15 s) in die aangeslagen toestand en beginnen dan onmiddellijk terug te vallen in de grondtoestand . Daarbij kan aanvankelijk energie aan de omgeving worden afgegeven door vibratierelaxatie. Dat betekent dat thermische energie wordt vrijgemaakt door de beweging van het atoom of molecuul totdat het laagste niveau van de tweede aangeslagen toestand is bereikt.
De grotere kloof tussen de tweede en de eerste aangeslagen toestand wordt overbrugd door interne omzetting. Dat beschrijft een elektronische overgang tussen twee toestanden terwijl de spin van elektronen behouden blijft. Nu kunnen de elektronen verder ontspannen door meer trillingsrelaxatie tot ze het laagste energieniveau van de S1-toestand bereiken.
Theoretisch zouden de elektronen nog verder kunnen ontspannen op een niet-radiatieve manier tot ze uiteindelijk weer de grondtoestand bereiken. Het kan echter zo zijn dat de laatste hoeveelheid energie te groot is om aan de omgeving te worden afgegeven, omdat de omringende moleculen niet zoveel energie kunnen absorberen. Dan treedt fluorescentie op, die leidt tot een emissie van fotonen met een bepaalde golflengte. De emissie duurt slechts totdat de elektronen weer in de grondtoestand zijn. Omdat bij al deze overgangen de elektronspin gelijk wordt gehouden, worden ze beschreven als spin-toegelaten.
Fosforescentie
Bij fosforescentie liggen de zaken een beetje anders (zie fig. 4). Er zijn weer een S0 grondtoestand en de twee aangeslagen toestanden, S1 en S2. Bovendien is er een aangeslagen triplet T1 toestand die energetisch tussen de S0 en S1 toestand ligt. De elektronen hebben weer antiparallelle spins in de grondtoestand.
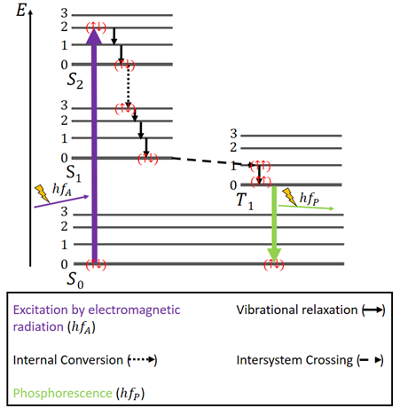
Figuur 4. Jablonski diagram voor fosforescentie.
Excitatie gebeurt op dezelfde manier als bij fluorescentie, namelijk door elektromagnetische straling. Het vrijkomen van energie door vibratierelaxatie en interne conversie met behoud van dezelfde spin is ook hier hetzelfde, maar alleen totdat de S1 toestand is bereikt.
Naast de singlet toestanden bestaat een triplet toestand en kan zogenaamde intersysteem crossing (ISC) optreden, aangezien de T1 toestand energetisch gunstiger is dan de S1 toestand. Deze kruising is, net als interne conversie, een elektronische overgang tussen twee aangeslagen toestanden. Maar in tegenstelling tot interne conversie, gaat ISC gepaard met een spin-omkering van singlet naar triplet. Elektronen in de triplet toestand hebben parallelle spins, wat wordt genoteerd als () . Dit ISC-proces wordt beschreven als “spin-verboden”. Het is niet volledig onmogelijk – vanwege een verschijnsel dat “spin-orbit koppeling” wordt genoemd – maar het is tamelijk onwaarschijnlijk.
In de T1-toestand is ook niet-radiatief verval mogelijk. Een overgang tussen het laagste energieniveau van de triplettoestand en de S0-toestand is echter niet goed mogelijk, omdat ook die overgang spin-verboden is. Toch kan het met een kleine mogelijkheid toch gebeuren. Het veroorzaakt een vrij zwakke emissie van fotonen omdat de elektronspin weer omgekeerd moet worden. De energie zit een tijdje gevangen in deze toestand en kan maar langzaam vrijkomen. Nadat alle energie is vrijgekomen, zijn de elektronen weer terug in de grondtoestand .
Conclusie
De spin-toegestane en -verboden processen dienen als verklaring voor een onmiddellijk ophoudend schijnsel van fluorescentie en voor het nagloeien van fosforescentie. Fosforescentie treedt gewoonlijk alleen op bij “zwaardere” moleculen, omdat de spin moet worden omgekeerd met behulp van spin-orbit-koppeling. Of er überhaupt elektromagnetische straling wordt uitgezonden, en met welke golflengte, hangt af van de hoeveelheid energie die van tevoren door niet-stralingsverval kan worden vrijgemaakt. Het hangt ook af van de eigenschappen van zogenaamde quenchers die omringende moleculen zijn en grotere hoeveelheden energie kunnen opnemen.
Alle processen die kunnen leiden tot een remming van radiatief verval kunnen fluorescentie quenching veroorzaken. Voorbeelden zijn niet-radiatieve vervalprocessen, maar ook de vernietiging van het fluorescerende molecuul. De quantum-efficiëntie beschrijft de efficiëntie van het proces en wordt gedefinieerd als de verhouding tussen geabsorbeerde en uitgezonden fotonen . Deze eigenschap is voor elke stof verschillend.
Ondanks dat deze tekst zich richt op fotoluminescentie, zijn de fotofysische processen voor alle soorten luminescentie hetzelfde.
Toepassingen
Naast producten zoals glowsticks, worden fluorescentie en fosforescentie op vele andere manieren gebruikt. Verdere voorbeelden zijn wegwijzers die naar een nooduitgang leiden, die geen elektrische voeding nodig hebben, maar ’s nachts gloeien door fosforescentie. Zelfs planten kunnen fluorescerend worden gemaakt: Spinazie kan met behulp van nanotechnologie zo worden gemodificeerd dat het sporen van explosieve stoffen in het grondwater kan opsporen. De bladeren bevatten koolstofnanobuisjes waaraan nitroaromaten zich kunnen hechten. Als ze dat doen, geeft de plant een fluorescerend signaal af dat met infraroodcamera’s kan worden gedetecteerd.
De video demonstreert verschillende soorten luminescentie. Links wordt onder UV-licht de fluorescentie getoond van de kleurstof curcumine, die aanwezig is in de specerij kurkuma. Curcumine wordt opgelost in alcohol om de fluorescentie zichtbaar te maken.
De plastic spin en de verbinding in het kleine buisje zijn voorbeelden van fosforescentie. Strontiumaluminaat, dat zich in het buisje bevindt, wordt aanvankelijk door UV-straling geëxciteerd en zendt uiteindelijk groen licht uit. De oorzaak hiervan is een doping met elementen als europium, die de verbinding bruikbaar maakt als luminescent pigment .
Het buigen van de glowstick (aan de rechterkant) brengt een chemische reactie op gang tussen waterstofperoxide en een kleurstof en fenyloxalaat. Chemiluminescentie kan worden waargenomen.
Video 1. Fluorescentie, fosforescentie en chemiluminescentie in vergelijking.
K. Arnold e.a., Chemie Oberstufe (in het Duits), Cornelsen Schulverlage, Berlijn, 2015, 496-497. ISBN: 978-3-06-011179-4
Lexikon der Physik: Lumineszenz (in het Duits), spektrum.de. (geraadpleegd 25 januari 2017)
D. Wiechoczek, Wenn Mineralien selber leuchten – Phosphoreszenz, Fluoreszenz und Lumineszenz (in het Duits), chemieunterricht.de 2010. (geraadpleegd 25 januari 2017)
Lexikon der Physik: Photophysikalische Prozesse (in het Duits), spektrum.de. (geraadpleegd 27 januari 2017)
D. Wiechoczek, Chemie mit Curry (in het Duits), chemieunterricht.de 2015. (accessed January 27, 2017)
P. W. Atkins, J. de Paula, Kurzlehrbuch Physikalische Chemie (in het Duits), Wiley-VCH, Weinheim, 2008, 853ff., 921ff. ISBN: 978-3-527-31807-0
P. W. Atkins, Physical Chemistry, Oxford University Press, 1994, 591ff.
Quantelung (in het Duits), chemie.de. (geraadpleegd op 27 januari 2017)
Bohr-frequentierelatie (in het Duits), chemgapedia.de. (geraadpleegd op 25 januari 2017)
Technische Universiteit Ilmenau, Practicum Fysische Chemie II: Fysische Chemie/Microreactietechnologie, Fluorescentiequenching Experiment (in het Duits), tu-ilmenau.de. (geraadpleegd op 27 januari 2017)
Stokes shift (in het Duits), chemie.de. (geraadpleegd op 25 januari 2017)
Elektronenspin (in het Duits), chemie.de. (geraadpleegd op 27 januari 2017)
Kwantumrendement (in het Duits), chemie.de. (geraadpleegd op 27 januari 2017)
Spinazie spoort explosieven op in grondwater (in het Duits), Spiegel Online, 1 november 2016. (geraadpleegd op 27 januari 2017)
D. Weiß, Phosphorescence (in het Duits), chemie.uni-jena.de. (geraadpleegd op 27 januari 2017)
 Kim Dreier is een leerling aan het Marianne-Weber-Gymnasium (middelbare school) in Lemgo, Duitsland.
Kim Dreier is een leerling aan het Marianne-Weber-Gymnasium (middelbare school) in Lemgo, Duitsland.