Deze structuur ontstaat wanneer twee (of meer, bv. ψ-lus) segmenten van een polypeptideketen elkaar overlappen en een rij waterstofbruggen met elkaar vormen. Dit kan gebeuren in een parallelle opstelling:

Of in een antiparallelle opstelling:
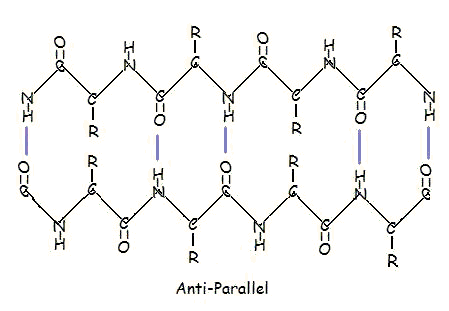
Parallelle en antiparallelle opstelling is het rechtstreekse gevolg van de richtinggevoeligheid van de polypeptideketen. Bij een antiparallelle rangschikking bevindt het C-terminusuiteinde van het ene segment zich aan dezelfde kant als het N-terminusuiteinde van het andere segment. Bij parallelle rangschikking bevinden het C-terminusuiteinde en het N-terminusuiteinde zich voor beide segmenten aan dezelfde kant. De “plooi” ontstaat door de wisselende vlakken van de peptidebindingen tussen aminozuren; de uitgelijnde amino- en carbonylgroep van elk tegenoverliggend segment wisselen hun oriëntatie af van naar elkaar gericht tot naar tegengestelde richtingen.
De parallelle rangschikking is minder stabiel omdat de geometrie van de individuele aminozuurmoleculen de waterstofbruggen dwingt onder een hoek te ontstaan, waardoor ze langer en dus zwakker worden. In de antiparallelle rangschikking daarentegen zijn de waterstofbruggen recht tegenover elkaar gericht, wat sterkere en stabielere bindingen oplevert.
Een antiparallelle bètaplaat wordt gewoonlijk gevormd wanneer een polypeptideketen sterk van richting verandert. Dit kan gebeuren in aanwezigheid van twee opeenvolgende proline residuen, die een hoekige knik in de polypeptideketen maken en deze op zichzelf terugbuigen. Dit is niet noodzakelijk voor verafgelegen segmenten van een polypeptideketen om bèta-geplooide vellen te vormen, maar voor proximale segmenten is het een absolute vereiste. Voor korte afstanden worden de twee segmenten van een beta-geplooide plaat gescheiden door 4+2n aminozuurresiduen, waarbij 4 het minimum aantal residuen is.