Introduction
Het menselijk brein ondergaat een uitgebreide maturatie gedurende het leven om de cognitieve ontwikkeling te vergemakkelijken. De myelinisatie van axonen in het zenuwstelsel is zo’n cruciaal rijpingsproces. In het centrale zenuwstelsel (CZS) strekken gliacellen, oligodendrocyten genaamd, vele processen uit in hun omgeving, die concentrisch membraan om axonen wikkelen om myelinescheden te vormen. Myelinescheden maken de snelle saltatorische geleiding van actiepotentialen mogelijk, door spanningsafhankelijke Na+ kanalen te lokaliseren in korte openingen tussen aangrenzende scheden (bekend als de knopen van Ranvier), en door te fungeren als elektrische isolatoren. Axonen die over hun gehele lengte volledig gemyeliniseerd zijn, geleiden vele malen sneller impulsen dan ongemyeliniseerde axonen met dezelfde doorsnede (Waxman, 1980). Daarom geleiden gemyeliniseerde neurale circuits informatie veel sneller dan ongemyeliniseerde circuits. Mensen worden geboren met een vrijwel ongemyeliniseerd CZS, en de oligodendrocyten populatie breidt zich dramatisch uit na de geboorte met wijdverspreide myelinisatie in de eerste paar jaar van de kindertijd. Myelinisatie gaat door tijdens de adolescentie en in de volwassenheid op een karakteristieke spatiotemporele manier, die correleert met het ontstaan en behoud van de juiste circuit functie. Bijvoorbeeld, de rijping van witte stof (de myeline-rijke gebieden van het CZS) is gelijktijdig met de ontwikkeling van kinderlijke cognitieve processen, zoals informatieverwerkingssnelheid (Mabbott et al., 2006; Scantlebury et al., 2014). Daarnaast worden myeline pathologie/afwijkingen niet alleen gezien bij de demyeliniserende ziekte Multiple Sclerose, maar ook bij verschillende neurodegeneratieve ziekten (Kang et al., 2013; Huang et al., 2015) en neurologische ontwikkelingsstoornissen (Takahashi et al., 2011). Echter, myelinisatie van individuele axonen is niet een “alles-of-niets” fenomeen. Axonen in het CZS vertonen uitgebreide variatie in myelineschede aantal, schede lengte, schede dikte, en distributie over hun lengte. Er bestaan veel verschillende patronen van myelinisatie; axonen met dun gemyeliniseerde regio’s zijn bijvoorbeeld beschreven in juveniele en volwassen muizen cortex (Tomassy et al., 2014; Hill et al., 2018; Hughes et al., 2018). Wijziging van een van deze mantelparameters heeft voorspelbare effecten op de geleidingssnelheid van het onderliggende axon – daarom kan het vaststellen van een specifiek patroon van myelinisatie langs een axon bijzonder belangrijk zijn voor het afstemmen van circuitfunctie. Bijvoorbeeld, axonen in de auditieve hersenstam van gerbils vertonen progressief kortere myelineschedes langs distale regio’s om de precieze timing van signaalaankomst te verzekeren om geluidslokalisatie te vergemakkelijken (Ford et al., 2015). Subtiele veranderingen in het algemene myelinepatroon langs een axon (hetzij door de toevoeging van nieuwe myeline, hetzij door de hermodellering van bestaande myeline) kunnen de timing van neurale impulsen in circuits ingrijpend veranderen. Als myeline aanpasbaar is, dan kan het wijzigen van dergelijke myelinisatiepatronen een krachtig mechanisme zijn voor het reguleren van circuitfuncties gedurende het hele leven.
Recent bewijs suggereert dat myeline aanpasbaar kan zijn in reactie op circuitactiviteit. Whole-brain diffusion tensor imaging kan worden gebruikt om brede veranderingen in de myeline-rijke witte stof in de tijd te meten – dergelijke experimenten bij mensen en knaagdieren hebben aangetoond dat het leren van een nieuwe taak correleert met witte stof veranderingen in relevante hersengebieden (Scholz et al., 2009; Sampaio-Baptista et al., 2013). Analyses op cellulair niveau in diermodellen tonen aan dat de productie van nieuwe myeliniserende oligodendrocyten vereist is voor efficiënt motorisch leren (McKenzie et al., 2014; Xiao et al., 2016). Momenteel wordt verondersteld dat neurale circuitactiviteit veranderingen in myeline teweeg kan brengen; een uitgebreid corpus van onderzoek heeft aangetoond dat neuronale activiteit de proliferatie van oligodendrocyte precursorcellen (OPC’s), de differentiatie van oligodendrocyten, en de vorming en groei van myelinescheden kan beïnvloeden. Dit onderzoek, inclusief bewijs voor de betrokken moleculaire signalen, is elders uitgebreid besproken (Fields, 2015; Almeida en Lyons, 2017; Mount en Monje, 2017). Neuronale activiteit zou veranderingen in myeline kunnen aansturen, die op hun beurt geleidingssnelheden zouden kunnen veranderen om de timings die de circuitfunctie onderbouwen af te stemmen.
We weten echter nog steeds niet of en hoe de myelinisatie van circuits dynamisch gedurende het leven wordt gereguleerd. Het werk van knaagdieren geeft aan dat nieuwe oligodendrocyten worden gegenereerd in het hele CZS, zelfs op volwassen leeftijd (Young et al., 2013), en OPC’s bevinden zich in de menselijke volwassen hersenen (Chang et al., 2000). Koolstofdatering analyse van menselijk weefsel heeft oligodendrocyten van volwassen oorsprong geïdentificeerd in de cortex, hoewel dezelfde analyses aangaven dat de meerderheid van de oligodendrocyten in het corpus callosum afkomstig zijn uit de vroege kindertijd (Yeung et al., 2014). Echter, de neuroimaging studies bij mensen die correleren witte stof structurele veranderingen met taak leren suggereren dat nieuwe myeline kan worden gevormd gedurende het hele leven. Dergelijke langdurige myelinisatie zou in principe levenslange oligodendrocytenproductie vereisen, gezien het feit dat individuele myeliniserende oligodendrocyten een beperkt tijdsvenster van slechts enkele uren hebben om de vorming van nieuwe omhulsels te initiëren (Watkins et al., 2008; Czopka et al., 2013) en het aantal omhulsels per oligodendrocyt stabiel lijkt in de tijd (Tripathi et al., 2017). Een voorbehoud opgemerkt door Mount en Monje (2017) is dat de “geboorte” datum in het carbon-dating experiment (die het tijdstip van DNA replicatie tijdens celdeling identificeert), die van de OPC weerspiegelt, niet noodzakelijkerwijs de gedifferentieerde oligodendrocyt. Dit is belangrijk gezien het bewijs dat OPC’s direct kunnen differentiëren in oligodendrocyten zonder celdeling, althans bij knaagdieren (Hughes et al., 2013). OPC’s in het corpus callosum zouden vele jaren na hun terminale celdeling direct kunnen differentiëren in oligodendrocyten; het tijdstip van differentiatie van deze nieuwe oligodendrocyten kan dus niet worden bepaald door koolstofdatering, en dus hebben Yeung et al. (2014) de snelheid van oligodendrocytenproductie in de volwassen menselijke hersenen mogelijk onderschat. We hebben nog veel te leren over de relatieve bijdragen van oligodendrocyte generatie en myeline remodellering aan de ontwikkeling van het CZS gedurende het hele leven.
Om de precieze dynamiek van oligodendrogenese, myelinevorming en myeline remodellering gedurende verschillende levensfasen volledig te begrijpen, vertegenwoordigt longitudinale beeldvorming met hoge resolutie de gouden-standaard benadering. Hier geven we een overzicht van recente in vivo beeldvormingsstudies die de dynamiek van myelinisatie beginnen te verduidelijken, waardoor we ook kunnen beginnen te begrijpen hoe dergelijke dynamiek de functie van neurale circuits zou kunnen beïnvloeden.
De novo Myelinisatie
Om definitief te beginnen te onderzoeken hoe oligodendrocyten worden gegenereerd en hoe myeline wordt gemaakt en dynamisch in vivo wordt geremodelleerd, hebben twee recente studies gebruikgemaakt van herhaalde twee-foton beeldvorming van de somatosensorische cortex van de muis gedurende langere perioden van tijd. Hughes et al. (2018) brachten de cortex van transgene reportermuizen met fluorescent gelabelde oligodendrogliale lijncellen in beeld vanaf de vroege volwassenheid, tot middelbare en hoge leeftijd (ongeveer P720). Zij vonden dat de oligodendrocyte bevolking blijft uitbreiden en dat corticale oligodendrocyte dichtheid bijna verdubbelt tussen jong volwassene en middelbare leeftijd stadia (Figuur 1A). Dit ging gepaard met een meer dan tweevoudige toename van het aantal corticale myelinescheden. Maar hoe neemt het aantal oligodendrocyten toe? In de vroege post-natale ontwikkeling veel oligodendrocyten worden geproduceerd, maar slechts een subset overleven en ga op myelinate axonen (Barres et al., 1992). Dit lijkt vergelijkbaar te zijn in de volwassenheid – door het volgen van individuele corticale OPC’s in de volwassen cortex voor maximaal 50 dagen, Hughes et al. (2018) bleek dat de meerderheid van de nieuw gedifferentieerde oligodendrocyten celdood ondergaan, met slechts 22% overleven en zich verbinden aan myelinisatie (figuur 1B). Het blijft onbekend welk deel van de nieuw gedifferentieerde oligodendrocyten worden gegenereerd na OPC-deling versus directe differentiatie. Echter, zodra oligodendrocyten zich verbinden tot myelinisatie blijven ze stabiel, met geen bewijs van myeliniserende oligodendrocyten ondergaan celdood tijdens een 50-daagse beeldvorming periode.
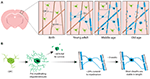
FIGUUR 1. Oligodendrocyte en myeline dynamiek in de zoogdieren cortex gedurende het hele leven. (A) Oligodendrocyte voorlopercellen (OPC’s) genereren voortdurend nieuwe myeliniserende oligodendrocyten (OL’s) in de somatosensorische cortex vanaf de geboorte tot middelbare leeftijd. De OL populatie neemt af op oudere leeftijd, vergezeld van een vermindering van de myeline dekking. (B) Lineage-tracing van enkele OPCs toont aan dat, hoewel premyeliniserende OLs continu geproduceerd worden in de volwassenheid, slechts ongeveer 20% overleeft om te myeliniseren. De meeste myelinescheden, eens gevormd, zijn stabiel in lengte over een langere periode, wat erop wijst dat er normaal heel weinig hermodellering van bestaande myeline is. Samenvatting van gegevens van Hill et al. (2018) en Hughes et al. (2018).
Op vergelijkbare wijze gebruikten Hill et al. (2018) transgene reporters van oligodendrocyten en de labelvrije spectrale confocale reflectie (SCoRe) microscopietechniek om myeline langs axonen in beeld te brengen (Schain et al., 2014) in de somatosensorische cortex van juveniele, jongvolwassen, muizen van middelbare leeftijd en van hoge leeftijd (P950). Zij vonden ook dat het aantal oligodendrocyten zich blijft uitbreiden in de volwassenheid tot P650, en dat oligodendrocyten stabiel zijn in de middelbare leeftijd tot 80 dagen van beeldvorming. Zij vonden dat myelinisatie van de cortex ook pieken in middelbare leeftijd op P650, en dat oligodendrocyte dichtheid aanzienlijk daalt van de piek (op P650) door middel van zeer hoge leeftijd (P950) (Figuur 1A). Dit werd weerspiegeld in een vermindering van myeline dekking van laag I corticale axonen tussen P650 en P950. Langdurige overleving van oligodendrocyten kan variëren tussen verschillende delen van het CZS. Tripathi et al. (2017) labelden myeliniserende oligodendrocyten op P60 in muizen en telden vervolgens hoeveel gelabelde cellen overleefden tot P605 in verschillende regio’s van het CZS. Zij vonden dat in het ruggenmerg en de motorische cortex, 60-70% van de P60 gelabelde cellen overleefden, terwijl in het corpus callosum, meer dan 90% van de P60 gelabelde cellen overleefden. De vermindering van het aantal oligodendrocyten en van de myelinisatie in bepaalde regio’s van het CZS met de leeftijd doet intrigerende vragen rijzen over de rol van myelineverlies in leeftijdsgebonden cognitieve achteruitgang. MRI analyse laat zien dat witte stof microstructuur correleert met vloeiende intelligentie (Ritchie et al., 2015), maar ook dat deze witte stof microstructuur verslechtert met toenemende leeftijd (Cox et al., 2016). Daaropvolgend leeftijdsgeassocieerd myelineverlies zou kunnen leiden tot een verminderde cognitieve functie als gevolg van ontregeling van gemyeliniseerde circuits.
Zou de generatie van nieuwe oligodendrocyten (en vervolgens nieuwe myeline) in de volwassen cortex responsief kunnen zijn voor circuitactiviteit? Eerder onderzoek heeft aangetoond dat het verminderen van sensorische input door het verwijderen van snorharen bij muizen leidt tot verminderde oligodendrogenese in de somatosensorische cortex (Hill et al., 2014). Om dit verder te onderzoeken, voorzagen Hughes et al. (2018) volwassen (P365) muizen gedurende 3 weken van zintuiglijke stimulatie door kralen in de dierenkooien te hangen om herhaaldelijk hun snorharen en daarmee de somatosensorische cortex te stimuleren. Door beeldvorming van de somatosensorische cortex voor en na de 3 weken toonden zij aan dat sensorische stimulatie het aantal oligodendrocyten verhoogt, mogelijk door de verhoogde overleving van nieuw gedifferentieerde cellen. Kougioumtzidou et al. (2017) leverden verder bewijs dat circuitactiviteit belangrijk kan zijn bij het reguleren van celoverleving – zij toonden aan dat verlies van AMPA-receptorsubeenheden 2, 3, en 4 in OPC’s leidt tot verminderde overleving van oligodendrocyten. Dit suggereert dat de de novo myelinisatie zou kunnen worden gemoduleerd door corticale circuit activiteit gedurende het hele leven, misschien om de functie van diezelfde circuits te fine-tunen.
Vele vragen moeten nog worden beantwoord: wat is het effect van oligodendrogenese en nieuwe myelinisatie op de huidige circuit functie? Verhoogt neuronale activiteit de overleving op lange termijn van myeliniserende oligodendrocyten? Het is mogelijk dat het verlies van oligodendrocyten op oudere leeftijd te wijten is aan een leeftijdsgebonden vermindering van neuronale activiteit, die op zijn beurt de algemene overleving van oligodendrocyten zou kunnen beïnvloeden. Een andere mogelijkheid is dat oligodendrocyten een beperkte levensduur hebben onafhankelijk van neuronale activiteit (hetzij intrinsiek geprogrammeerd of beïnvloed door andere extrinsieke signalen die geassocieerd worden met veroudering). In beide gevallen zou stimulatie van het circuit het leeftijdsgebonden myelineverlies kunnen helpen verlichten door ofwel de overleving van bestaande oligodendrocyten te bevorderen ofwel de aanmaak van nieuwe oligodendrocyten te stimuleren. Dit zou op zijn beurt belangrijke implicaties kunnen hebben voor de behandeling en preventie van leeftijdsgeassocieerde cognitieve achteruitgang.
Activiteitsgemedieerde oligodendrogenese is niet beperkt tot de somatosensorische cortex – jongvolwassen muizen die motorisch leren ondergaan, vertonen ook een toename van het aantal nieuw gedifferentieerde oligodendrocyten in de motorische cortex (Xiao et al., 2016). Hoe zit het met andere gebieden van het CZS? Veel corticale axonen projecteren via het corpus callosum, en daarom zou stimulatie van corticale circuits een signaal kunnen afgeven aan zowel corticale als callosale OPC’s. Twee knaagdier studies hebben aangetoond dat stimulatie van corticale neuronen induceert oligodendrogenese binnen het corpus callosum. Gibson et al. (2014) optogenetisch gestimuleerd laag V projectie neuronen in de premotorische cortex, het vinden van een stijging van de OPC proliferatie in zowel de premotorische cortex en corpus callosum. Dit leidde tot een toename van het aantal oligodendrocyten en de schede dikte 4 weken na stimulatie. Meer recentelijk gebruikten Mitew et al. (2018) uitsluitend door Designer Receptors Activated by Designer Drugs om laag 2/3 somatosensorische neuronen te stimuleren, en observeerden ook een verhoogde OPC-proliferatie, oligodendrogenese, en dikkere myelinescheden in het corpus callosum in zowel juveniele als volwassen muizen. Zij toonden ook aan dat nieuwe oligodendrocyten bij voorkeur myelinescheden vormen op de actieve axonen. Dit wijst erop dat activiteit-geïnduceerde de novo myelinisatie in principe gericht kan zijn op actieve axonen/kringen. Het blijft onbekend hoe langetermijnveranderingen in myeline als reactie op neuronale activiteit kunnen zijn. De langdurige overleving van myeliniserende cellen opgemerkt door Tripathi et al. (2017), Hill et al. (2018), en Hughes et al. (2018) suggereert dat zodra een oligodendrocyt myelinescheden vormt, het waarschijnlijk is om te overleven, zelfs als neuronale activiteitsniveaus terugkeren naar de basislijn. Of de myelinescheden zelf veranderen zodra de neuronale activiteit terugkeert naar normale niveaus, vereist meer onderzoek naar de dynamiek van individuele scheden, die hieronder wordt besproken.
Hiermee is het mogelijk dat levenslange de novo myelinisatie optreedt in veel gebieden van het CZS, waar axonen die geschikt zijn voor myelinisatie voldoende ongemyeliniseerde ruimte hebben. Het blijft echter onduidelijk in welke mate oligodendrogenese doorgaat in verschillende gebieden van de volwassen menselijke hersenen. Koolstofdatering analyse suggereert dat de meeste oligodendrocyten in het corpus callosum tractus worden gegenereerd in de vroege kindertijd (Yeung et al., 2014). Immunohistochemische analyse van menselijk hersenweefsel met behulp van een nieuwe marker voor nieuw gedifferentieerde oligodendrocyten (BCAS1) toont nieuwe oligodendrocyten in de frontale cortex zelfs na de middelbare leeftijd, maar zeer weinig nieuwe oligodendrocyten in de witte stof na het derde decennium van het leven (Fard et al., 2017). Dit verschil in oligodendrogenese tussen soorten zou een gevolg kunnen zijn van schaalgrootte. De gegevens van Hughes et al. (2013) knaagdieren suggereren dat oligodendrocyten in enorme overmaat worden gegenereerd, met continue snoei van bijna 80% van de cellen. Is dit mechanisme, gezien de energiekosten van een dergelijk proces, levenslang houdbaar in een orgaan met de omvang van het menselijk brein? Misschien is er in de menselijke hersenen een beperkte overproductie van oligodendrocyten, vanwege een behoefte aan meer langdurige myelinisatie van het grotere CZS, of omdat signalen zoals neuronale activiteit OPC’s stimuleren om te differentiëren in oligodendrocyten als en wanneer dat nodig is.
Myelin Remodelling
Het hermodelleren van bestaande myelinescheden zou geleidingseigenschappen kunnen veranderen zonder de noodzaak van het genereren van nieuwe oligodendrocyten of myeline. Het veranderen van de lengte van bestaande myelineschedes zou de myelinebedekking langs een axon en de afstand tussen knooppunten van Ranvier kunnen veranderen (wat beide van invloed zou zijn op geleidingssnelheden). Bovendien kan zelfs een zeer subtiele hermodellering van de myeline de lengte van de knooppunten zelf veranderen. Recent is aangetoond dat de knooppuntlengte in de oogzenuw en in de cortex sterk kan variëren, en dat het veranderen van de knooppuntlengtes langs een axon in principe ook de geleidingssnelheid aanzienlijk kan veranderen (Arancibia-Cárcamo et al., 2017). Of veranderingen in de knoop van Ranvier primair worden gedreven door myelinisatie of reorganisatie van het axon zelf, moet nog worden bepaald.
Zowel Hill et al. (2018) als Hughes et al. (2018) voerden longitudinale studie uit van individuele myelinescheden in de somatosensorische cortex van de muis gedurende meerdere weken om te beoordelen of schede lengtes dynamisch worden gereguleerd. Hill et al. (2018) vonden dat, in de vroege volwassenheid (P90-120), hoewel sommige scheden verlenging of krimp vertonen, 81% van de waargenomen scheden stabiel waren. Meer scheden kunnen stabiel in lengte worden met de leeftijd; Hughes et al. (2018) volgden scheden in oudere (P365) dieren en zagen dat 99% van de scheden stabiel bleef gedurende 3 weken (Figuur 1B).
Zo’n schede lengte stabiliteit is ook elders beschreven; Auer et al. (2018) gebruikten larvale zebravis om te onderzoeken of individuele scheden in de loop van de tijd in lengte kunnen veranderen door het uitvoeren van time-course live beeldvorming van fluorescent gelabelde myelinescheden. Zij ontdekten dat individuele scheden een snelle maar variabele groei ondergaan in de eerste paar dagen na de vorming, voordat ze hun schedellengte stabiliseren. Eenmaal gestabiliseerd, blijven de omhulsels alleen groeien om de algemene groei van het dier aan te passen.
Waarom veranderen sommige omhulsels in de cortex in lengte, terwijl andere dat niet doen? Dit kan diversiteit weerspiegelen in de eisen van de verschillende neurale circuits. Axonale diversiteit is waargenomen tijdens initiële myelinisatie in het ruggenmerg van de zebravis, waar sommige axonen synaptische vesicle-afgifte gebruiken om myelineschede-aantal en -lengte te reguleren, terwijl andere dat niet doen (Koudelka et al., 2016). Dit roept de intrigerende hypothese op dat slechts sommige axonen in staat zijn om myeline te reguleren via activiteitsgerelateerde signalen. Hughes et al. (2018) vonden dat hun sensorische stimulatieparadigma het aandeel dynamische mantels in de somatosensorische cortex niet deed toenemen. Echter, meer gedetailleerde analyse van axon subtype diversiteit gekoppeld aan longitudinale studie van schede lengte dynamiek zou kunnen bevestigen of schede lengte hermodellering specifiek is voor bepaalde circuits.
Wordt schede lengte stabiliteit weerspiegelt een onvermogen van scheden om te hermodelleren? Experimenten in de zebravis suggereren dat schede lengte hermodellering kan worden geïnduceerd wanneer het myelinisatieprofiel van een axon wordt verstoord. Auer et al. (2018) ablceerden enkele oligodendrocyten en verwijderden daardoor spaarzaam mantels langs axonen. Zij vonden dat wanneer een enkele myelineschede verloren gaat op een volledig gemyeliniseerd axon, de naburige scheden opnieuw een snelle groei konden initiëren om de ongemyeliniseerde kloof te bedekken. In verschillende gevallen zou een nieuwe myelineschede zich vormen in de plaats van zijn voorganger en zou zelfs kunnen terugduwen tegen de binnendringende naburige scheden om het oorspronkelijke patroon van myelinisatie te herstellen (Figuur 2A). Daarom is soms een specifieke myelinisatie patroon bij voorkeur gehandhaafd, zelfs na myeline verstoring. Dit kan zijn om de geoptimaliseerde geleidingseigenschappen van het onderliggende axon in stand te houden. Auer et al. (2018) observeerden spaarzaam gemyeliniseerde axonen in de larvale zebravis, zoals eerder geïdentificeerd in de knaagdier cortex. Interessant is dat zij vonden dat bij ablatie van enkele mantels op dergelijke dun gemyeliniseerde axonen een nieuwe schede gevormd op vrijwel dezelfde plaats als de geabliseerde schede, zelfs langs een anders ongemyeliniseerd stuk van het axon (Figuur 2B). Aldus lijken de myelinisatiepatronen langs spaarzaam gemyeliniseerde axonen ook stabiel te worden gehandhaafd in de zebravis, zoals gesuggereerd door Hill et al. (2018) in knaagdieren. De functie van spaarzame myelinisatieprofielen blijft onbekend. Dergelijke patronen kunnen een meer dynamische afstemming van de functie van afzonderlijke axonen in de loop van de tijd mogelijk maken, hoewel het ook mogelijk is dat dergelijke ongemyeliniseerde lacunes geleidelijke myelinisatie vergemakkelijken om consistente geleidingstijden binnen circuits te handhaven, naarmate het dier groeit en / of axonlengtes veranderen.
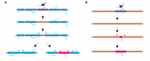
FIGUUR 2. Myeline remodellering kan optreden in vivo. (A) Ablatie van enkele omhulsels op een volledig gemyeliniseerd axon kan leiden tot snelle groei van naburige omhulsels om de kloof te dichten. Deze kloof kan ofwel volledig bedekt worden door de naburige mantels, ofwel kan het oorspronkelijke myelinisatieprofiel hersteld worden door de toevoeging van een nieuwe schede. (B) Ablatie van een schede op een dun gemyeliniseerd axon wordt gevolgd door de vorming van een nieuwe myelineschede van identieke grootte en locatie als de verwijderde voorganger schede. Samenvatting van gegevens van Auer et al. (2018).
Hebben stabiele myelinescheden bij zoogdieren ook dit vermogen om te hermodelleren wanneer het myelinisatiepatroon wordt verstoord? Verdere longitudinale studies gekoppeld aan demyelinisatie zijn nodig om deze vraag te beantwoorden. Het is mogelijk dat deze remodellering niet wordt geïnduceerd door neuronale activiteit maar een compensatiemechanisme is voor myelineverlies. Ouderdomsgeassocieerd verlies van oligodendrocyten zou kunnen leiden tot hermodellering van overlevende myelinescheden om gedenatureerde delen van axonen te bedekken en zo te helpen de circuitfunctie te behouden. Live beeldvorming van myelinescheden op oudere leeftijd zou kunnen bepalen of dit het geval is.
De hier besproken live beeldvormende studies hebben allemaal de dynamiek van de myelineschede-lengte beoordeeld, maar niet de dikte van de myelineschede. Kan de dikte van de schede dynamisch worden gereguleerd? Het stimuleren van PI3K/AKT/mTOR signalering in oligodendrocyten van volwassen muizen triggert extra myeline wikkeling om de manteldikte te verhogen (Snaidero et al., 2014). Dit kan worden gemoduleerd door circuitactiviteit, aangezien neuronale stimulatie leidt tot toegenomen manteldikte in zowel juveniele als volwassen muizen (Gibson et al., 2014; Mitew et al., 2018). Dit benadrukt de noodzaak om alle schede parameters longitudinaal in beeld te brengen om de dynamiek van schede hermodellering volledig te begrijpen. Er is behoefte aan live-imaging modaliteiten om de manteldikte langs axonen nauwkeurig te meten, aangezien dit momenteel doorsnede metingen via elektronenmicroscopie vereist, wat de analyse beperkt tot een enkel tijdstip. Sommige labelvrije beeldvormingstechnieken, zoals derde harmonische generatie microscopie en spectrale reflectometrie, tonen belofte voor het uitvoeren van dergelijke metingen (Lim et al., 2014; Kwon et al., 2017). Het koppelen van deze technieken aan longitudinale studies van de knaagdier cortex zou kunnen bepalen of gevestigde myelinescheden hun dikte kunnen aanpassen, of dat neuronale activiteit gewoon de novo myelinisatie duwt om dikkere scheden te produceren.
Het lijkt er daarom op dat, hoewel myelinescheden in staat zijn om te hermodelleren wanneer myeline wordt verstoord, de meeste scheden over het algemeen stabiel zijn in lengte. Deze stabiliteit is mogelijk te wijten aan het behoud van vroeg gevestigde myelinisatie patronen geoptimaliseerd voor circuit functie.
De toekomst
Recente zoogdieren beeldvormende studies hebben zich gericht op de novo myelinisatie en schede hermodellering in corticale grijze stof. Corticale circuits ontvangen en verzenden informatie via vele regio’s, zoals het ruggenmerg en het corpus callosum, en dus kunnen veranderingen in myeline in verschillende gebieden van het CZS de signalisatie in een enkel circuit veranderen. Het CZS wordt traditioneel beschreven op basis van het uitzicht na formaldehyde fixatie, waarbij “witte stof” de zwaar gemyeliniseerde axonale tracés beschrijft, terwijl “grijze stof” de gebieden beschrijft die dicht opeengepakt zijn met neuronale cellichamen, dendrieten en synapsen. Deze classificatie is echter te simplistisch; OPC’s produceren myeliniserende oligodendrocyten in zowel grijze als witte stof (Dawson et al., 2003), en in feite is er steeds meer bewijs van diversiteit in de oligodendrogliale lijn en in patronen van myelinisatie in zowel grijze als witte stof (Rivers et al., 2008; Viganò et al., 2013; Young et al., 2013; Bechler et al., 2015). Deze diversiteit kan de unieke vereisten van myeline in verschillende gebieden, en mogelijk op verschillende circuits, van het CZS weerspiegelen. Verdere longitudinale beeldvormingsstudies zijn nodig om de dynamiek van de novo myelinisatie en schede hermodellering beter te begrijpen in gebieden van het CZS buiten de cortex.
Want de optische transparantie van de larvale zebravis leent zich voor niet-invasieve live imaging, het uitvoeren van dergelijke experimenten in de zoogdieren CZS is meer invasief en technisch uitdagend. Hill et al. (2018) en Hughes et al. (2018) gebruik gemaakt van twee-foton microscopie met craniale beeldvensters om beeld dieptes tot 400 pm in de cortex. Vergelijkbare technieken kunnen worden gebruikt om oppervlakkige gemyeliniseerde traktaten in het ruggenmerg in de tijd af te beelden (Locatelli et al., 2018), maar diepere CNS-regio’s kunnen niet worden doorgedrongen met twee-fotonmicroscopie alleen. Een alternatief is het gebruik van twee-foton microendoscopie, waarbij een microendoscoopsonde met een gradiënt brekingsindex (GRIN) lens in het weefsel wordt ingebracht om cellen dieper in de hersenen af te beelden . Het inbrengen van de endoscoop kan echter leiden tot ontstekingsreacties die de myelinisatie kunnen beïnvloeden. Een alternatief zou drie-fotonmicroscopie kunnen zijn met behulp van de craniale beeldvormingsraammethode, die eerder ook is gebruikt om de hippocampus in beeld te brengen (Horton et al., 2013; Ouzounov et al., 2017). Drie-fotonmicroscopie geeft een aanzienlijk grotere signaal-achtergrondverhouding dan twee-fotonmicroscopie en kan daarom worden gebruikt om diepere weefselstructuren in beeld te brengen.
Het is bijzonder belangrijk om niet alleen verschillende CZS-regio’s te beschouwen, maar ook verschillende neuronen binnen deze regio’s. Eerder onderzoek suggereert dat er mechanistische verschillen zijn in hoe verschillende neuronsubtypen hun myelinisatie reguleren (Koudelka et al., 2016). Daarnaast kan er diversiteit zijn in de lokale regulatie van myeline. Het is essentieel om te onthouden dat verschillende delen van het CZS geen afzonderlijke entiteiten zijn, maar onderling met elkaar verbonden zijn. Het integreren van mesoschaal connectomics, dat zich richt op het begrijpen van de verbindingen van verschillende neuronsubtypen in verschillende regio’s (Zeng, 2018), zal van cruciaal belang zijn voor ons begrip van hoe levenslange myelinisatiedynamiek varieert tussen verschillende circuits.
Wat is het functionele gevolg van myeline regulatie langs verschillende circuits? Tot nu toe kunnen de functionele gevolgen alleen worden afgeleid uit correlaties met gedrag. Uiteindelijk is er behoefte om metingen van myeline dynamiek te koppelen aan directe beoordeling van circuit activiteit. Dit vereist de registratie van neuronale activiteit tijdens longitudinale studies van myelinisatie om de waargenomen de novo myelinisatie of hermodellering van de myelineschede direct te koppelen aan veranderingen in circuitfunctie in de tijd. Het zal belangrijk zijn om de myeline dynamiek en de elektrofysiologische activiteit van individuele neuronen en axonen te meten om te bepalen hoe veranderingen in de verschillende myelineschede parameters de geleidingseigenschappen beïnvloeden op het niveau van de individuele cel, alsook om de activiteit op populatieniveau te evalueren. Hulpmiddelen zoals genetisch gecodeerde Ca2+- of spanningsindicatoren maken relatief niet-invasieve registratie van circuitactiviteit mogelijk, en kunnen zelfs worden gebruikt om circuitactiviteit in de hele hersenen te beoordelen (Ahrens et al., 2012; Lovett-Barron et al., 2017).
Conclusie
De myelinisatie van axonen vertegenwoordigt een krachtig potentieel mechanisme om de circuitfunctie gedurende het hele leven te reguleren. Onderzoek heeft aangetoond dat de novo myelinisatie in de cortex (via de productie van nieuwe oligodendrocyten) zelfs op volwassen leeftijd optreedt, en dat dit kan worden versterkt door het stimuleren van circuitactiviteit. Eenmaal myeline gevormd, is het stabiel met weinig turnover van oligodendrocyten en beperkte hermodellering van de lengtes van bestaande myelinescheden. Deze stabiele structuren kunnen echter de capaciteit behouden om te hermodelleren als de myeline wordt verstoord. Dit heeft interessante implicaties voor de plasticiteit van myeline bij het in stand houden van de circuitfunctie tijdens verwonding, ziekte en ouderdom. Hoe veranderingen in myelinisatie precies de functie van het onderliggende circuit beïnvloeden, moet nog blijken. Uiteindelijk is een circuit-niveau aanpak, de integratie van analyse van myeline dynamiek met directe meting van circuit functie, nodig om volledig te waarderen hoe dynamische myelinisatie beïnvloedt het totale zenuwstelsel functie gedurende het leven.
Author Contributions
Alle genoemde auteurs hebben een substantiële, directe en intellectuele bijdrage geleverd aan het werk, en goedgekeurd voor publicatie.
Funding
DAL wordt ondersteund door een Wellcome Trust Senior Research Fellowship (102836/Z/13/Z). JMW wordt ondersteund door een University of Edinburgh Ph.D. Tissue Repair Studentship Award (MRC Doctoral Training Partnership MR/K501293/1) en het Wellcome Trust Four-Year Ph.D. Program in Tissue Repair (Grant 108906/Z/15/Z).
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in de afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Ahrens, M. B., Li, J. M., Orger, M. B., Robson, D. N., Schier, A. F., Engert, F., et al. (2012). Hersenbrede neuronale dynamiek tijdens motorische adaptatie in de zebravis. Nature 485, 471-477. doi: 10.1038/nature11057
PubMed Abstract | CrossRef Full Text | Google Scholar
Almeida, R. G., and Lyons, D. A. (2017). Over gemyeliniseerde axon plasticiteit en neuronale circuit vorming en functie. J. Neurosci. 37, 10023-10034. doi: 10.1523/JNEUROSCI.3185-16.2017
CrossRef Full Text | Google Scholar
Arancibia-Cárcamo, I. L., Ford, M. C., Cossell, L., Ishida, K., Tohyama, K., and Attwell, D. (2017). Node of Ranvier length as a potential regulator of myelinated axon conduction speed. eLife 6:e23329. doi: 10.7554/eLife.23329
PubMed Abstract | CrossRef Full Text | Google Scholar
Auer, F., Vagionitis, S., and Czopka, T. (2018). Bewijs voor myelineschede remodeling in het CZS geopenbaard door in vivo beeldvorming. Curr. Biol. 28, 549-559. doi: 10.1016/j.cub.2018.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Barres, B. A., Hart, I. K., Coles, H. S. R., Burne, J. F., Voyvodic, J. T., Richardson, W. D., et al. (1992). Cell death and control of cell survival in the oligodendrocyte lineage. Cell 70, 31-46. doi: 10.1016/0092-8674(92)90531-G
CrossRef Full Text | Google Scholar
Bechler, M. E., Byrne, L., and Ffrench-Constant, C. (2015). CNS myelineschede lengtes zijn een intrinsieke eigenschap van oligodendrocyten. Curr. Biol. 25, 2411-2416. doi: 10.1016/j.cub.2015.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, A., Nishiyama, A., Peterson, J., Prineas, J., and Trapp, B. D. (2000). NG2-positive oligodendrocyte progenitor cells in adult human brain and multiple sclerosis lesions. J. Neurosci. 20, 6404-6412. doi: 10.1523/JNEUROSCI.20-17-06404.2000
PubMed Abstract | CrossRef Full Text | Google Scholar
Cox, S. R., Ritchie, S. J., Tucker-Drob, E. M., Liewald, D. C., Hagenaars, S. P., Davies, G., et al. (2016). Ageing and brain white matter structure in 3,513 UK Biobank participants. Nat. Commun. 7:13629. doi: 10.1038/ncomms13629
PubMed Abstract | CrossRef Full Text | Google Scholar
Czopka, T., Ffrench-Constant, C., and Lyons, D. A. (2013). Individual oligodendrocytes have only a few hours in which to generate new myelin sheaths in vivo. Dev. Cell 25, 599-609. doi: 10.1016/j.devcel.2013.05.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Dawson, M. R. L., Polito, A., Levine, J. M., and Reynolds, R. (2003). NG2-expressing glial progenitor cells: an abundant and widespread population of cycling cells in the adult rat CNS. Mol. Cell. Neurosci. 24, 476-488. doi: 10.1016/S1044-7431(03)00210-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Fard, M. K., Van der Meer, F., Sánchez, P., Cantuti-Castelvetri, L., Mandad, S., Jäkel, S., et al. (2017). BCAS1 expressie definieert een populatie van vroege myeliniserende oligodendrocyten in multiple sclerose laesies. Sci. Transl. Med. 9:eaam7816. doi: 10.1126/scitranslmed.aam7816
PubMed Abstract | CrossRef Full Text | Google Scholar
Fields, R. D. (2015). Een nieuw mechanisme van plasticiteit van het zenuwstelsel: activiteit-afhankelijke myelinisatie. Nat. Rev. Neurosci. 16, 756-767. doi: 10.1038/nrn4023
PubMed Abstract | CrossRef Full Text | Google Scholar
Ford, M. C., Alexandrova, O., Cossell, L., Stange-Marten, A., Sinclair, J., Kopp-Scheinpflug, C., et al. (2015). Tuning of Ranvier node and internode properties in myelinated axons to adjust action potential timing. Nat. Commun. 6:8073. doi: 10.1038/ncomms9073
PubMed Abstract | CrossRef Full Text | Google Scholar
Gibson, E. M., Purger, D., Mount, C. W., Goldstein, A. K., Lin, G. L., Wood, L. S., et al. (2014). Neuronale activiteit bevordert oligodendrogenese en adaptieve myelinisatie in het zoogdierenbrein. Science 344:1252304. doi: 10.1126/science.1252304
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Li, A. M., and Grutzendler, J. (2018). Levenslange corticale myeline plasticiteit en leeftijdsgebonden degeneratie in het levende zoogdierenbrein. Nat. Neurosci. 21, 683-695. doi: 10.1038/s41593-018-0120-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Patel, K. D., Goncalves, C. M., Grutzendler, J., and Nishiyama, A. (2014). Modulation of oligodendrocyte generation during a critical temporal window after NG2 cell division. Nat. Neurosci. 17, 1518-1527. doi: 10.1038/nn.3815
PubMed Abstract | CrossRef Full Text | Google Scholar
Horton, N. G., Wang, K., Kobat, D., Clark, C. G., Wise, F. W., Schaffer, C. B., et al. (2013). In vivo driefotonmicroscopie van subcorticale structuren in een intact muizenbrein. Nat. Photonics 7, 205-209. doi: 10.1038/NPHOTON.2012.336
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, B., Wei, W., Wang, G., Gaertig, M. A., Feng, Y., Wang, W., et al. (2015). Mutant huntingtin downreguleert myeline regulerende factor-gemedieerde myeline genexpressie en beïnvloedt rijpe oligodendrocyten. Neuron 85, 1212-1226. doi: 10.1016/j.neuron.2015.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Kang, S. H., Fukaya, M., and Bergles, D. E. (2013). Oligodendrocyte progenitors balanceren groei met zelf-afstoting om homeostase te bereiken in de volwassen hersenen. Nat. Neurosci. 16, 668-676. doi: 10.1038/nn.3390
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., and Bergles, D. E. (2018). Myeline remodeling door ervaring-afhankelijke oligodendrogenese in de volwassen somatosensorische cortex. Nat. Neurosci. 21, 696-706. doi: 10.1038/s41593-018-0121-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Jung, J. C., Mehta, A. D., Aksay, E., Stepnoski, R., and Schnitzer, M. J. (2004). In vivo beeldvorming van zoogdierenhersenen met behulp van één- en twee-foton fluorescentie microendoscopie. J. Neurophysiol. 92, 3121-3133. doi: 10.1152/jn.00234.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kang, S. H., Li, Y., Fukaya, M., Lorenzini, I., Cleveland, D. W., Ostrow, L. W., et al. (2013). Degeneratie en verminderde regeneratie van grijze stof oligodendrocyten in amyotrofe laterale sclerose. Nat. Neurosci. 16, 571-579. doi: 10.1038/nn.3357
PubMed Abstract | CrossRef Full Text | Google Scholar
Koudelka, S., Voas, M. G., Almeida, R. G., Baraban, M., Soetaert, J., Meyer, M. P., et al. (2016). Individuele neuronale subtypes vertonen diversiteit in CNS myelinisatie gemedieerd door synaptische vesicle release. Curr. Biol. 26, 1447-1455. doi: 10.1016/j.cub.2016.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Kougioumtzidou, E., Shimizu, T., Hamilton, N. B., Tohyama, K., Sprengel, R., Monyer, H., et al. (2017). Signalering via AMPA-receptoren op oligodendrocyte precursoren bevordert myelinisatie door oligodendrocyte overleving te verbeteren. eLife 6:e28080. doi: 10.7554/eLife.28080
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, J., Kim, M., Park, H., Kang, B.-M., Jo, Y., Kim, J.-H., et al. (2017). Label-vrije nanoschaal optische metrologie op gemyeliniseerde axonen in vivo. Nat. Commun. 8:1832. doi: 10.1038/s41467-017-01979-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., and Webb, W. W. (2004). In vivo multiphoton microscopie van diep hersenweefsel. J. Neurophysiol. 91, 1908-1912. doi: 10.1152/jn.01007.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lim, H., Sharoukhov, D., Kassim, I., Zhang, Y., Salzer, J. L., and Melendez-Vasquez, C. V. (2014). Label-vrije beeldvorming van Schwann cel myelinisatie door derde harmonische generatie microscopie. Proc. Natl. Acad. Sci. U.S.A. 111, 18025-18030. doi: 10.1073/pnas.1417820111
PubMed Abstract | CrossRef Full Text | Google Scholar
Locatelli, G., Theodorou, D., Kendirli, A., Jordão, M. J. C., Staszewski, O., Phulphagar, K., et al. (2018). Mononucleaire fagocyten specificeren lokaal en passen hun fenotype aan in een multiple sclerose model. Nat. Neurosci. 21, 1196-1208. doi: 10.1038/s41593-018-0212-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett-Barron, M., Andalman, A. S., Allen, W. E., Vesuna, S., Kauvar, I., Burns, V. M., et al. (2017). Voorouderlijke circuits voor de gecoördineerde modulatie van de hersentoestand. Cell 171, 1411-1423. doi: 10.1016/j.cell.2017.10.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Mabbott, D. J., Noseworthy, M., Bouffet, E., Laughlin, S., and Rockel, C. (2006). White matter growth as a mechanism of cognitive development in children. Neuroimage 33, 936-946. doi: 10.1016/j.neuroimage.2006.07.024
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenzie, I. A., Ohayon, D., Li, H., Paes de Faria, J., Emery, B., Tohyama, K., et al. (2014). Motorische vaardigheid leren vereist actieve centrale myelinisatie. Science 346, 318-322. doi: 10.1126/science.1254960
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitew, S., Gobius, I., Fenlon, L. R., McDougall, S. J., Hawkes, D., Xing, Y. L., et al. (2018). Farmacogenetische stimulatie van neuronale activiteit verhoogt myelinisatie op een axon-specifieke manier. Nat. Commun. 9:306. doi: 10.1038/s41467-017-02719-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mount, C. W., and Monje, M. (2017). Wrapped to adapt: experience-dependent myelination. Neuron 95, 743-756. doi: 10.1016/j.neuron.2017.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Ouzounov, D. G., Wang, T., Wang, M., Feng, D. D., Horton, N. G., Cruz-Hernández, J. C., et al. (2017). In vivo drie-foton beeldvorming van de activiteit van GCaMP6 gelabelde neuronen diep in intacte muizenhersenen. Nat. Methods 14, 388-390. doi: 10.1038/nmeth.4183
PubMed Abstract | CrossRef Full Text | Google Scholar
Ritchie, S. J., Bastin, M. E., Tucker-Drob, E. M., Maniega, S. M., Engelhardt, L. E., Cox, S. R., et al. (2015). Coupled changes in brain white matter microstructure and fluid intelligence in later life. J. Neurosci. 35, 8672-8682. doi: 10.1523/JNEUROSCI.0862-15.2015
PubMed Abstract |Ref Full Text | Google Scholar
Rivers, L. E., Young, K. M., Rizzi, M., Jamen, F., Psachoulia, K., Wade, A., et al. (2008). PDGFRA/NG2 glia genereren myeliniserende oligodendrocyten en piriform projectie neuronen in volwassen muizen. Nat. Neurosci. 11, 1392-1401. doi: 10.1038/nn.2220
PubMed Abstract | CrossRef Full Text | Google Scholar
Sampaio-Baptista, C., Khrapitchev, A. A., Foxley, S., Schlagheck, T., Scholz, J., Jbabdi, S., et al. (2013). Motorische vaardigheid leren induceert veranderingen in witte stof microstructuur en myelinisatie. J. Neurosci. 33, 19499-19503. doi: 10.1523/jneurosci.3048-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Scantlebury, N., Cunningham, T., Dockstader, C., Laughlin, S., Gaetz, W., Rockel, C., et al. (2014). Relations between white matter maturation and reaction time in childhood. J. Int. Neurophsychol. Soc. 20, 99-112. doi: 10.1017/S1355617713001148
PubMed Abstract | CrossRef Full Text | Google Scholar
Schain, A. J., Hill, R. A., and Grutzendler, J. (2014). Label-vrije in vivo beeldvorming van gemyeliniseerde axonen in gezondheid en ziekte met spectrale confocale reflectie microscopie. Nat. Med. 20, 443-449. doi: 10.1038/nm.3495
PubMed Abstract | CrossRef Full Text | Google Scholar
Scholz, J., Klein, M. C., Behrens, T. E. J., and Johansen-berg, H. (2009). Training induceert veranderingen in witte-stof architectuur. Nat. Neurosci. 12, 1370-1371. doi: 10.1038/nn.2412
PubMed Abstract | CrossRef Full Text | Google Scholar
Snaidero, N., Möbius, W., Czopka, T., Hekking, L. H. P., Mathisen, C., Verkleij, D., et al. (2014). Myeline membraan wrapping van CNS axonen door PI(3,4,5)P3-afhankelijke gepolariseerde groei aan de binnenste tong. Cell 156, 277-290. doi: 10.1016/j.cell.2013.11.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Takahashi, N., Sakurai, T., Davis, K. L., and Buxbaum, J. D. (2011). Linking oligodendrocyte and myelin dysfunction to neurocircuit abnormalities in schizophrenia. Prog. Neurobiol. 93, 13-24. doi: 10.1016/j.pneurobio.2010.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tomassy, G. S., Berger, D. R., Chen, H.-H., Kasthuri, N., Hayworth, K. J., Vercelli, A., et al. (2014). Distinct profiles of myelin distribution along single axons of pyramidal neurons in the neocortex. Science 344, 319-324. doi: 10.1126/science.1249766
PubMed Abstract | CrossRef Full Text | Google Scholar
Tripathi, R. B., Jackiewicz, M., Mckenzie, I. A., Kougioumtzidou, E., Grist, M., and Richardson, W. D. (2017). Opmerkelijke stabiliteit van myeliniserende oligodendrocyten bij muizen. Cell Rep. 21, 316-323. doi: 10.1016/j.celrep.2017.09.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Viganò, F., Möbius, W., Götz, M., and Dimou, L. (2013). Transplantatie onthult regionale verschillen in oligodendrocyt differentiatie in de volwassen hersenen. Nat. Neurosci. 16, 1370-1372. doi: 10.1038/nn.3503
PubMed Abstract | CrossRef Full Text | Google Scholar
Watkins, T. A., Emery, B., Mulinyawe, S., and Barres, B. A. (2008). Distinct stages of myelination regulated by gamma-secretase and astrocytes in a rapidly myelinating CNS coculture system. Neuron 60, 555-569. doi: 10.1016/j.neuron.2008.09.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Waxman, S. G. (1980). Determinants of conduction velocity in myelinated nerve fibers. Muscle Nerve 3, 141-150. doi: 10.1002/mus.880030207
PubMed Abstract | CrossRef Full Text | Google Scholar
Xiao, L., Ohayon, D., Mckenzie, I. A., Sinclair-Wilson, A., Wright, J. L., Fudge, A. D., et al. (2016). Snelle productie van nieuwe oligodendrocyten is vereist in de vroegste stadia van het aanleren van motorische vaardigheden. Nat. Neurosci. 19, 1210-1217. doi: 10.1038/nn.4351
PubMed Abstract | CrossRef Full Text | Google Scholar
Yeung, M. S. Y., Zdunek, S., Bergmann, O., Bernard, S., Salehpour, M., Alkass, K., et al. (2014). Dynamiek van oligodendrocytengeneratie en myelinisatie in het menselijk brein. Cell 159, 766-774. doi: 10.1016/j.cell.2014.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Young, K. M., Psachoulia, K., Tripathi, R. B., Dunn, S.-J., Cossell, L., Attwell, D., et al. (2013). Oligodendrocyte dynamics in the healthy adult CNS: evidence for myelin remodeling. Neuron 77, 873-885. doi: 10.1016/j.neuron.2013.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, H. (2018). Mesoschaal connectomics. Curr. Opin. Neurobiol. 50, 154-162. doi: 10.1016/j.conb.2018.03.003
PubMed Abstract | CrossRef Full Text | Google Scholar