Aspartaat aminotransferase door Luke Spooner
Inhoud
- 1 Functie
- 2 Structuur
- 3 Functie
- 4 Klinische toepassingen
- 5 3D-structuren van aspartaataminotransferase
Functie
Aspartaataminotransferase (AAT), ook bekend als Glutamic aspartic transaminase, glutamic oxaloacetic transaminase, prephenate aminotransferase en transaminase A is een enzym dat lid is van de klasse-I pyridoxaal-fosfaat-afhankelijke aminotransferase familie. Het wordt gecodeerd door het gen GOT1. Het is een homodimeer van 413 aminozuren lang en speelt een cruciale rol in het aminozuur- en koolhydraatmetabolisme, de ureogenese en de overdracht van reductie-equivalenten naar de mitochondriën en de chloroplasten. In prokaryote cellen wordt het uitsluitend in het cytosol aangetroffen, maar in eukaryote cellen zijn er cytosol-, mitochondriale en chloroplastisozymes. Bifunctioneel aspartaat aminotransferase (BAAT) is nodig voor de transaminering van prephanaat in arogenaat.
In het menselijk lichaam wordt het geproduceerd in de hersenen, skeletspieren, lever, pancreas, rode bloedcellen en nieren. Het grote aantal weefsels waarin het wordt aangemaakt, onderscheidt het van het soortgelijke enzym alaninetransaminase (ALT), dat hoofdzakelijk in de lever wordt aangetroffen. Het niveau van AAT in het lichaam kan worden gebruikt als een marker voor weefselziekte of -beschadiging. Ook kunnen AAT- en ALT-niveaus worden vergeleken om vast te stellen of weefselschade hoofdzakelijk in de lever wordt aangetroffen.
Structuur
die (Alfa-helixen, Beta-strengen , Lussen , Draaien) bevat. Asymmetrische eenheid van Aspartaat aminotransferase, met gemarkeerd klein en groot domein en PLP cofactor (1b4x). Elke subeenheid bevat een equivalente actieve plaats. De subeenheden verbinden elkaar op twee plaatsen: tussen hun grote domeinen en tussen de N-terminale residuen en het grote domein op de andere subeenheid. Deze structuur van AST varieert miniem tussen organismen, van E. coli tot de mens. Ook de structuur van de actieve site is met een sequentiehomologie van 25% in hoge mate geconserveerd.
Elke subeenheid van het homodimeer is verder verdeeld in een klein en een groot domein. Het kleine domein bestaat uit de aminozuren van de N-terminus tot de Pro 48 residu en van Met 326 tot de C-terminus. De overige aminozuren vormen het , en de zijn verbonden door een lange α-helix bestaande uit 32 aminozuren.
Het grote domein is waar zich de actieve plaats van AAT bevindt en om dit te accommoderen bevat de kern vele α/β supersecundaire structuren. Dit staat in contrast met de kern van de kleine subeenheid die wordt gevormd door twee α-helices en twee β-strengen. In meercellige organismen is er een knik bij het 325e residu dat als scharnier fungeert voor het kleine domein, waardoor de resulterende conformatieveranderingen kunnen optreden bij binding van remmers aan het enzym.
Zoals hierboven is gezegd, bevindt de actieve site van AST zich op het grote domein van de subeenheid. Binnen de actieve zone bevindt zich het aminoresidu Lys 258, ook bekend als het interne aldimine, dat zich bindt met de cofactor Pyridoxal 5′-fosfaat () en zo een zogenaamde Schiff base vormt. Bij toevoeging van een aminozuursubstraat wordt een nieuwe Schiff base gevormd tussen PLP en het aminozuur.
Functie
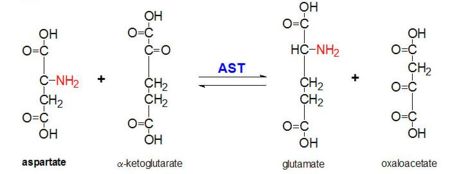
Figuur 2: Transaminatiereactie van L-aspartaat en α-ketoglutaraat gekatalyseerd door aspartaataminotransferase
AAT katalyseert de omkeerbare transaminering van de α-aminogroep van L-aspartaat naar α-ketoglutaraat waarbij oxaloacetaat en glutamaat worden gevormd. Deze reactiviteit is lager in E.coli dan in hogere eukaryoten, en heeft een bredere substraatspecificiteit. De reactie verloopt echter op dezelfde wijze. Wanneer een aminozuursubstraat wordt ingebracht, vormt zich een nieuwe Schiff base tussen dit substraat en de PLP-cofactor. Hierdoor verliest het aminozuur een waterstof en vormt een quinoide tussenproduct, waarna reprotanatie plaatsvindt met als resultaat een ketimine. Vervolgens wordt de structuur gehydrolyseerd, waarbij een α-ketonzuur en pyridoxaminefosfaat ontstaan. 2-methylaspartaat werkt als een remmer van AAT wanneer het een Schiif base vormt met de PLP-cofactor, in plaats van aspartaat. Dit heeft tot gevolg dat het proces stopt bij de stap vóór de eliminatie van het alfa-eiwit.
Deze reactie is essentieel voor het handhaven van de homeostase in organismen. De vier verschillende moleculen die als gevolg van deze transanimatie kunnen worden gevormd (oxaloacetaat, α-ketoglutaraat, aspartaat, L-glutamaat) zijn van cruciaal belang voor een aantal stofwisselingsprocessen. Oxaloacetaat en α-ketoglutaraat spelen een cruciale rol in de Krebs-cyclus, verschillende vormen van aspartaat zijn belangrijke moleculen in de ureumcyclus en nemen deel aan de gluconeogenese, en glutamaat is een belangrijke molecule in metabolische routes die verband houden met het geheugen.
Klinische toepassingen
De niveaus van AAT in het lichaam zijn indicatief voor weefselschade en ziekte. Normaal wordt AAT in minimale hoeveelheden in het bloed aangetroffen, doch wanneer de bovengenoemde organen beschadigd zijn, komt AAT in het bloed vrij. De hoeveelheid die vrijkomt is evenredig met de mate van de opgelopen schade. Het is aangetoond dat de AAT-spiegels binnen 6 uur na de eerste weefselbeschadiging aanzienlijk stijgen en tot 4 dagen lang verhoogd kunnen blijven. Vergelijking van het AAT-gehalte met het gehalte van andere enzymen kan door artsen worden gebruikt om vast te stellen waar in het lichaam de schade heeft plaatsgevonden. Vergelijkingen met ALT zijn bijzonder nuttig gebleken bij het vaststellen van leverschade zoals cirrose en hepatitis. Onder normale omstandigheden bedraagt het AAT-gehalte bij mannen 6-34 IU/L en bij vrouwen 8-40 IU/L.
3D-structuren van aspartaataminotransferase
Aspartaataminotransferase 3D-structuren