Algemene eigenschappen van zouten
Enkele van de karakteristieke eigenschappen van zouten zijn:
- Smelt- en kookpunten: Zouten zijn meestal vaste stoffen die zowel smelten als koken bij hoge temperaturen.
- Oplosbaarheid in water: Zouten zijn over het algemeen oplosbaar in water. Bijvoorbeeld natriumchloride, kaliumsulfaat, aluminiumnitraat, ammoniumcarbonaat, enz. zijn oplosbare zouten, terwijl zilverchloride, loodchloride, kopercarbonaat, enz. niet oplosbaar zijn in water.
- Kristallisatiewater: Over het algemeen worden zouten aangetroffen als kristallen met daarin aanwezige watermoleculen. Dit water wordt kristallisatiewater genoemd en dergelijke zouten worden gehydrateerde zouten genoemd.
Bij voorbeeld, kopersulfaatkristal heeft vijf watermoleculen voor elke kopersulfaatmolecule. Dit wordt geschreven als CuSO4.5H2O. Dit kristalwater geeft het kristal zijn vorm. Het geeft ook kleur aan sommige kristallen. Bij verhitting verliezen gehydrateerde zouten hun kristalwater en als gevolg daarvan verliezen de kristallen hun vorm en kleur en veranderen in een poedervormige substantie.
De gehydrateerde zouten die hun kristalwater hebben verloren, worden watervrije zouten genoemd.
Wanneer gehydrateerd kopersulfaat wordt verhit, geeft het watermoleculen af en vormt wit poederig watervrij kopersulfaat. Bij toevoeging van water kan deze stof zich weer omzetten in een gehydrateerde kopersulfaatoplossing.
Vragen mensen ook
- Classificatie van zouten
- Gebruiken van verschillende zouten in het dagelijks leven
- Bereiding van zouten
- Beschrijf de bereiding van oplosbare en onoplosbare zouten
- Kwantitatieve Analyse van zouten
- Warmtewerking op zouten
- Test voor kationen en anionen in waterige oplossingen
- Opstellen van ionische vergelijkingen met behulp van de continue variatiemethode
- Wat is stoichiometrie en waarom wordt het in de scheikunde gebruikt?
Algemene eigenschappen van zouten :
1. Reactie met een zuur : Wanneer een zout met een zuur reageert, worden een ander zout en een zuur gevormd. Wanneer bijvoorbeeld natriumchloride met zwavelzuur wordt verhit, ontstaat natriumwaterstofsulfaat (bij lage temperatuur) en vervolgens natriumsulfaat (bij hoge temperatuur), waarbij waterstofchloridegas vrijkomt.
2. Reactie met een base : Een zout reageert met een base waarbij een ander zout en een base ontstaan.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH
3. Reactie met een metaal : Soms kan een zoutoplossing reageren met een metaal. Wanneer bijvoorbeeld een ijzeren spijker in een waterige oplossing van kopersulfaat wordt gedompeld, slaat koper neer op het oppervlak van de spijker en blijft het gevormde ijzersulfaat in de oplossing achter.
CuSO4 + Fe → FeSO4 + Cu
Uit deze reactie blijkt dat ijzer reactiever is dan koper.
Dus kan een meer reactief metaal een minder reactief metaal uit een oplossing van zijn zout verdringen.
4. Gedrag van zouten ten opzichte van water :
Wanneer een zout in water wordt opgelost, kan de oplossing neutraal, zuur of alkalisch zijn. Dit hangt af van de aard van het gebruikte zout.
(i) Een normaal zout, afgeleid van een sterk zuur en een sterke base, geeft een neutrale oplossing. Bijvoorbeeld de waterige oplossingen van NaCl en K2SO4 zijn neutraal voor lakmoes.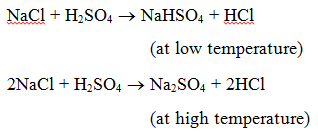
(ii) Een normaal zout dat is afgeleid van een zwak zuur en een sterke base geeft een alkalische oplossing. Bijvoorbeeld, de waterige oplossingen van zowel natriumcarbonaat (Na2CO3) als natriumacetaat (CH3COONa) zijn alkalisch.
Na2CO3 + 2H2O → 2NaOH + CO2 + H2O
CH3COONa + H2O → CH3COOH + NaOH
(iii) Een zout afgeleid van een sterk zuur en een zwakke base geeft een zure oplossing. Bijvoorbeeld, zowel aluminiumchloride (AlCl3) als ammoniumchloride (NH4Cl) maken zure waterige oplossingen.
AlCl3 + 3H2O → Al(OH)3 + 3HCl
NH4Cl + H2O → NH4OH + HCl
(iv) Oplossingen van zure zouten zijn zuur voor lakmoes, d.w.z., deze oplossingen kleuren blauw lakmoespapier rood. Bijvoorbeeld, een oplossing van natriumwaterstofsulfaat (NaHSO4) kleurt blauw lakmoespapier rood.
Natriumwaterstofcarbonaat (NaHCO3) oplossing, echter, is licht alkalisch.