Leerdoelen
- Om eenvoudige (rechte-keten) alkanen gegeven formules te identificeren en te benoemen en formules te schrijven voor rechte-keten alkanen gegeven hun namen.
We beginnen onze studie van de organische chemie met de koolwaterstoffen, de eenvoudigste organische verbindingen, die alleen uit koolstof- en waterstofatomen zijn samengesteld. Zoals we hebben opgemerkt, zijn er verschillende soorten koolwaterstoffen. Zij onderscheiden zich door het type binding tussen de koolstofatomen en de eigenschappen die uit die binding voortvloeien. Koolwaterstoffen met uitsluitend enkelvoudige koolstof-koolstofbindingen (C-C) en bestaande als een continue keten van koolstofatomen die ook gebonden zijn aan waterstofatomen, worden alkanen (of verzadigde koolwaterstoffen) genoemd. Verzadigd betekent in dit geval dat elk koolstofatoom gebonden is aan vier andere atomen (waterstof of koolstof) – het maximum dat mogelijk is; er zijn geen dubbele of drievoudige bindingen in de moleculen.
Het woord verzadigd heeft voor koolwaterstoffen dezelfde betekenis als voor de voedingsvetten en -oliën: het molecuul heeft geen dubbele bindingen van koolstof tot koolstof (C=C).
We hebben eerder de drie eenvoudigste alkanen – methaan (CH4), ethaan (C2H6) en propaan (C3H8) – geïntroduceerd en ze zijn opnieuw afgebeeld in figuur
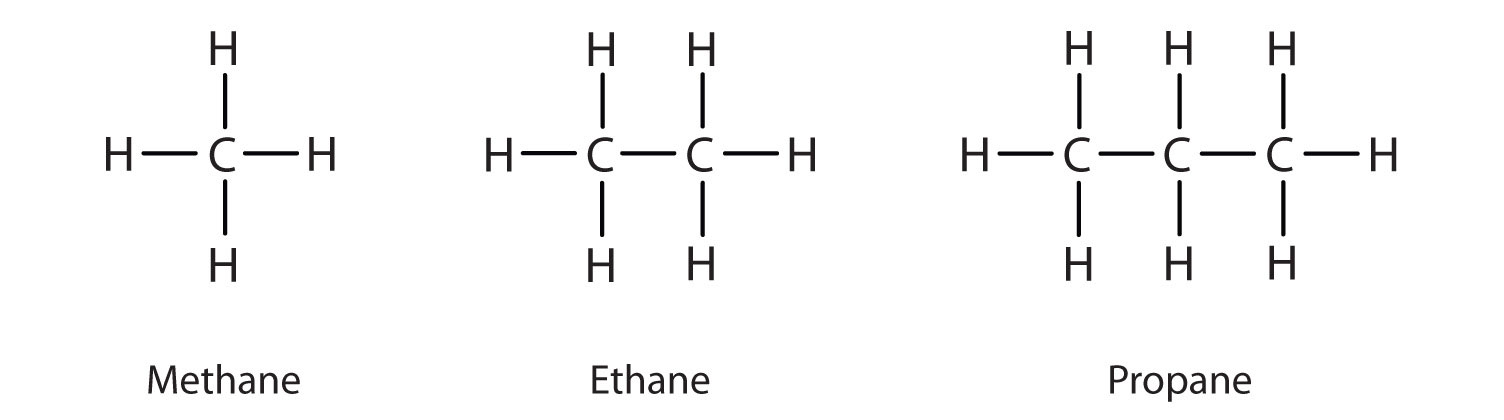

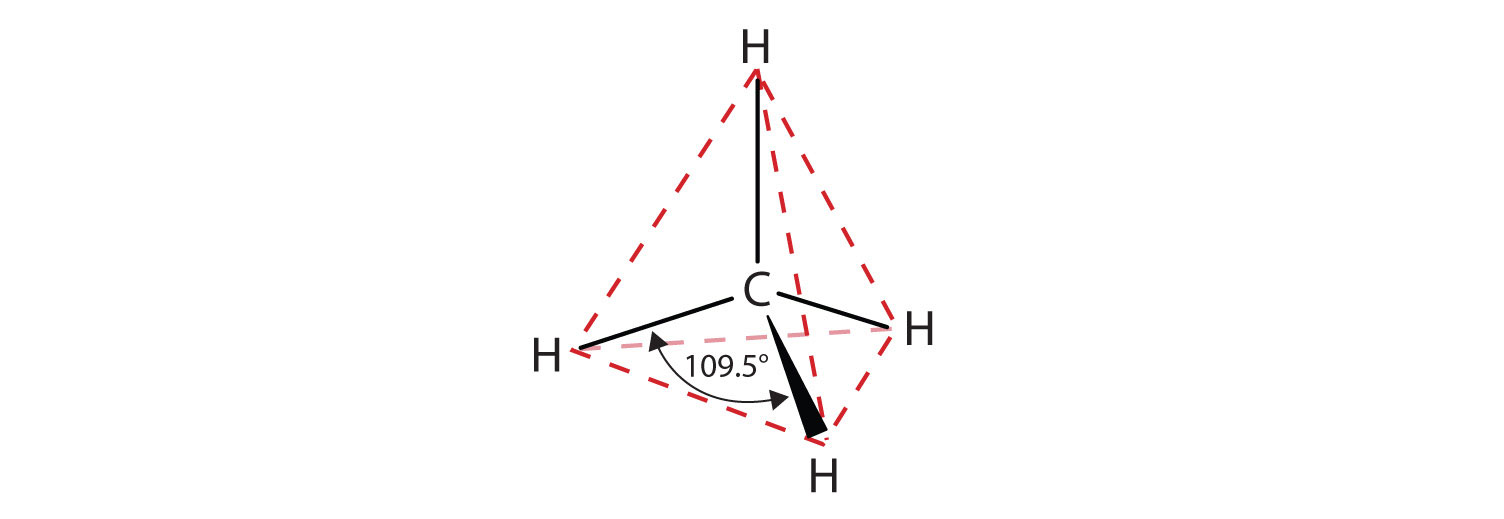
De afgebeelde platte voorstellingen geven de bindingshoeken en de moleculaire geometrie niet nauwkeurig weer. Methaan heeft een tetrahedrale vorm die chemici vaak afbeelden met wiggen die bindingen aangeven die naar je toe komen en stippellijnen die bindingen aangeven die van je af gaan. Een gewone ononderbroken lijn geeft een binding in het vlak van de bladzijde aan. Herinner je dat de VSEPR-theorie correct een tetrahedrale vorm voorspelt voor het methaanmolecuul (figuur
Methaan (CH4), ethaan (C2H6) en propaan (C3H8) zijn het begin van een reeks verbindingen waarin twee leden in een reeks van elkaar verschillen door één koolstofatoom en twee waterstofatomen – een CH2-eenheid dus. De eerste 10 leden van deze reeks zijn gegeven in Tabel
| Name | Moleculaire formule (CnH2n + 2) | Condensed Structural Formula | Number of Mogelijke Isomeren |
|---|---|---|---|
| methaan | CH4 | – | |
| ethaan | C2H6 | CH3CH3 | – |
| propaan | C3H8 | CH3CH2CH3 | – |
| butaan | C4H10 | CH3CH2CH3 | 2 |
| pentaan | C5H12 | CH3CH2CH2CH3 | 3 |
| hexaan | C6H14 | CH3CH2CH2CH2CH3 | 5 |
| heptaan | C7H16 | CH3CH2CH2CH2CH3 | 9 |
| octaan | C8H18 | CH3CH2CH2CH2CH2CH3 | 18 |
| nonaan | C9H20 | CH3CH2CH2CH2CH2CH2CH3 | 35 |
| decaan | C10H22 | CH3CH2CH2CH2CH2CH2CH2CH3 | 75 |
Bekijk de reeks in figuur (\PageIndex{3}). De reeks begint met C3H8 en bij elke stap in de reeks wordt een CH2-eenheid toegevoegd. Elke familie van verbindingen waarin aangrenzende leden van elkaar verschillen door een bepaalde factor (hier een CH2 groep) wordt een homologe serie genoemd. De leden van een dergelijke reeks, die homologe verbindingen worden genoemd, hebben eigenschappen die op een regelmatige en voorspelbare manier variëren. Het homologieprincipe geeft organisatie aan de organische chemie op ongeveer dezelfde manier als het periodiek systeem organisatie geeft aan de anorganische chemie. In plaats van een verbijsterende reeks afzonderlijke koolstofverbindingen kunnen we een paar leden van een homologe reeks bestuderen en daaruit enkele eigenschappen van andere verbindingen in de reeks afleiden.
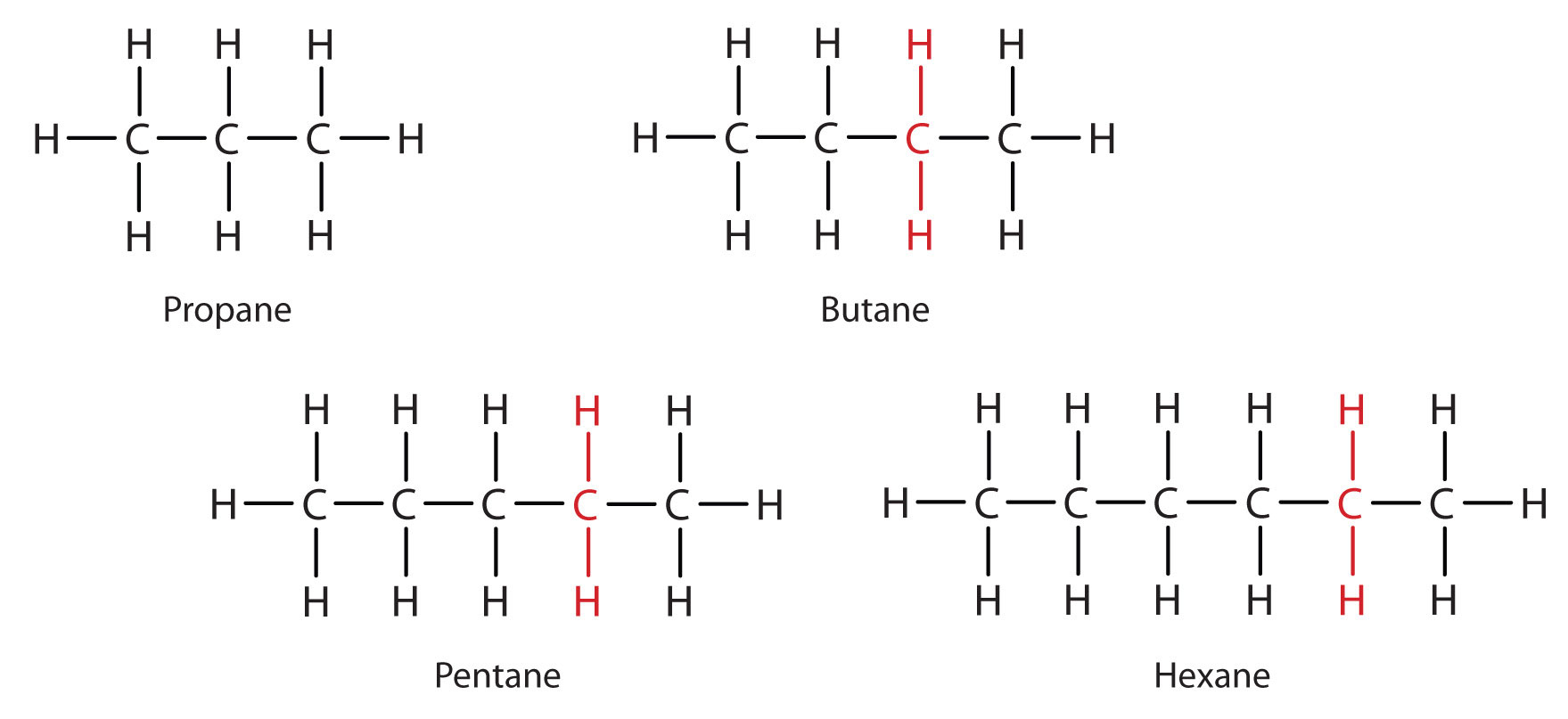
Het homologieprincipe stelt ons in staat een algemene formule voor alkanen te schrijven: CnH2n + 2. Met behulp van deze formule kunnen we een molecuulformule schrijven voor elk alkaan met een gegeven aantal koolstofatomen. Bijvoorbeeld, een alkaan met acht koolstofatomen heeft de moleculaire formule C8H(2 × 8) + 2 = C8H18.
Key Takeaway
- Eenvoudige alkanen bestaan als een homologe serie, waarin aangrenzende leden verschillen door een CH2 eenheid.