Voorstelling in chemische reacties
In dit hoofdstuk leren we enkele reacties kennen waarbij de belangrijkste stappen betrekking hebben op de beweging van enkelvoudige elektronen. U herinnert zich misschien nog wel uit paragraaf 6.1A dat de beweging van een enkel elektron wordt weergegeven door een ‘vishaak’-pijl met een enkele streep (in tegenstelling tot de bekende pijlen met een dubbele streep die we in het hele boek hebben gebruikt om de beweging van twee elektronen weer te geven).

Bij enkel-elektron mechanismen gaat het om de vorming en daaropvolgende reactie van vrije radicaalsoorten, zeer instabiele tussenproducten die een ongepaard elektron bevatten. We zullen in dit hoofdstuk leren hoe vrije radicalen vaak worden gevormd door homolytische splitsing, een gebeurtenis waarbij de twee elektronen in een verbrekende covalente binding in tegengestelde richting bewegen.

(In tegenstelling tot vrijwel alle reacties die we tot nu toe hebben bestudeerd, worden bindingen verbroken waarbij beide elektronen in dezelfde richting bewegen: dit wordt heterolytische splitsing genoemd).
We zullen ook leren dat veel enkel-elektron mechanismen de vorm aannemen van een radicale kettingreactie, waarbij een radicaal de vorming van een tweede radicaal veroorzaakt, die op zijn beurt de vorming van een derde radicaal veroorzaakt, enzovoort.
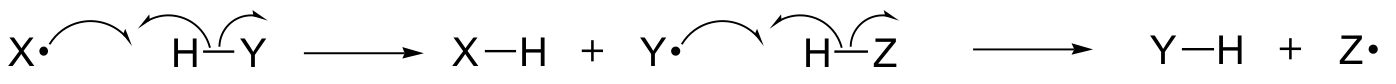
De hoge reactiviteit van vrije radicalen en hun vermogen om kettingreacties te initiëren is vaak nuttig – we zullen in dit hoofdstuk leren over radicale polymerisatiereacties die nuttige materialen vormen, zoals plexiglas en polypropeenweefsel. We zullen ook leren over radicale reacties die schadelijk zijn, zoals de afbraak van atmosferische ozon door freon, en de oxidatieve schade die door vrije radicalen wordt toegebracht aan lipiden en DNA in ons lichaam. Tenslotte zullen we zien hoe sommige enzymen gebonden metalen gebruiken om hoge e
De geometrie en relatieve stabiliteit van koolstofradicalen
Als organisch scheikundigen zijn we vooral geïnteresseerd in radicale tussenproducten waarin het ongepaarde elektron zich op een koolstofatoom bevindt. Experimenteel bewijs toont aan dat de drie bindingen in een koolstofradicaal een trigonale vlakke geometrie hebben, en daarom wordt de koolstof beschouwd als sp2-gehybridiseerd met het ongepaarde elektron dat de loodrechte, ongehybridiseerde 2pzorbital bezet. Vergelijk dit met de tussenproducten carbokation en carbanion, die beide ook trigonaal planair zijn, maar waarvan de 2pz-orbitalen respectievelijk nul of twee elektronen bevatten.

De trend in de stabiliteit van koolstofradicalen loopt gelijk met die van carbokationen (paragraaf 8.4B): tertiaire radicalen zijn bijvoorbeeld stabieler dan secundaire radicalen, gevolgd door primaire en methylradicalen. Dit zou intuïtief logisch moeten zijn, omdat radicalen, net als carbokationen, kunnen worden beschouwd als elektron-deficiënt, en dus worden gestabiliseerd door de elektron-donerende effecten van nabije alkylgroepen. Benzyl- en allylradicalen zijn stabieler dan alkylradicalen door resonantie-effecten – een ongepaard elektron kan worden gedelokaliseerd over een systeem van geconjugeerde pi bindingen. Een allylradicaal bijvoorbeeld kan worden voorgesteld als een systeem van drie parallelle 2pz-orbitalen die drie elektronen delen.
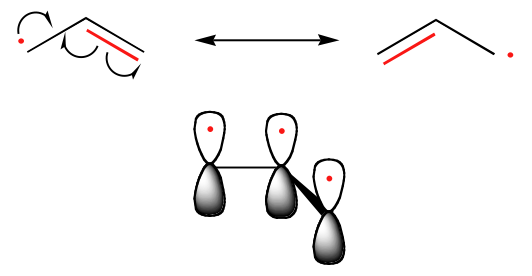
Trends in radicaalstabiliteit
Allylisch & Benzlisch > 3o > 2o > 1o > Methyl

In dit molecuul wordt de reeds uitgebreide resonantiestabilisatie nog versterkt door het vermogen van de chlooratomen om het radicale centrum af te schermen van externe reagentia. Het radicaal bevindt zich in zekere zin in een beschermende ‘kooi’.
Organische chemie met een biologisch accent door Tim Soderberg (Universiteit van Minnesota, Morris)
-
Prof. Steven Farmer (Sonoma State University)
- Layne A. Morsch (Universiteit van Illinois Springfield)