Introduction
人間の脳は、認知機能を発達させるために、生涯を通じて様々な成熟を遂げます。 神経系全体の軸索の髄鞘化は、そのような重要な成熟過程の一つです。 中枢神経系では、オリゴデンドロサイトと呼ばれるグリア細胞が周囲に多くの突起を伸ばし、軸索に同心円状に膜を巻きつけてミエリン鞘を形成しています。 ミエリン鞘は、電位依存性Na+チャネルを隣接する鞘の間の短い隙間(ランビエの節と呼ばれる)に局在させ、電気絶縁体として働くことにより、活動電位の速い塩基性伝導を可能にしている。 軸索が完全に有髄化されると、同じ断面積の無髄軸索に比べて何倍もの速さでインパルスが伝導される(Waxman, 1980)。 したがって、有髄の神経回路は無髄の回路よりもはるかに速く情報を伝達する。 ヒトは生まれつき髄鞘のないCNSを持っているが、オリゴデンドロサイトの集団は出生後劇的に拡大し、小児期の最初の数年間で広範囲に髄鞘が形成される。 髄鞘化は思春期から成人期まで、時空間的に特徴的に継続し、適切な回路機能の出現と維持に相関している。 例えば、白質(CNSの髄鞘が豊富な領域)の成熟は、情報処理速度などの小児期の認知過程の発達と同時進行します(Mabbottら、2006年、Scantleburyら、2014年)。 さらに、ミエリンの病理・異常は、脱髄疾患である多発性硬化症のみならず、いくつかの神経変性疾患(Kang et al., 2013; Huang et al., 2015)や神経発達障害(Takahashi et al., 2011)でも見られる。 しかし、個々の軸索の髄鞘化は、「オール・オア・ナッシング」の現象ではありません。 CNSの軸索は、ミエリン鞘の数、鞘の長さ、鞘の厚さ、長さ方向の分布に広範なバリエーションがあることが分かっています。 多くの異なる髄鞘形成のパターンが存在し、例えば、幼体および成体マウスの皮質において、まばらに髄鞘形成された領域を有する軸索が記載されている(Tomassyら、2014;Hillら、2018;Hughesら、2018)。 これらの鞘パラメータのいずれかに変更を加えると、基礎となる軸索の伝導速度に予測可能な影響を及ぼす-したがって、軸索に沿った髄鞘の特定のパターンを確立することは、回路機能を微調整するために特に重要であると考えられる。 例えば、スナネズミの聴覚脳幹の軸索は、音の定位を容易にするために、信号の到達タイミングを正確にするために、遠位領域に沿って徐々に短い髄鞘を示す(Ford et al.、2015)。 軸索に沿った髄鞘の全体的なパターンが微妙に変化すると(新しい髄鞘が追加されるか、既存の髄鞘が再形成されるか)、回路内の神経インパルスのタイミングが大きく変化する可能性があります。 ミエリンが適応的であれば、髄鞘形成のパターンを変更することは、生涯を通じて回路の機能を制御する強力なメカニズムになるかもしれない
最近の証拠は、ミエリンが回路の活動に応じて適応的であることを示唆している。 全脳拡散テンソル画像は、ミエリンが豊富な白質における経時的な幅広い変化を測定するために用いることができる。ヒトやげっ歯類におけるこうした実験により、新しい課題の学習が関連する脳領域の白質変化に相関していることが示されている(Scholzら、2009;Sampaio-Baptistaら、2013)。 動物モデルにおける細胞レベルの解析は、新しい髄鞘オリゴデンドロサイトの産生が効率的な運動学習に必要であることを示している(McKenzieら、2014年;Xiaoら、2016年)。 現在、神経回路の活動がミエリンの変化を引き起こすという仮説が立てられています。広範な研究により、神経細胞の活動がオリゴデンドロサイト前駆細胞(OPC)の増殖、オリゴデンドロサイトの分化、ミエリン鞘の形成と成長に影響を及ぼすことが実証されています。 関与する分子シグナルの証拠を含むこの研究は、他の場所で広範囲にレビューされている(Fields, 2015; Almeida and Lyons, 2017; Mount and Monje, 2017)。
しかし、回路の髄鞘化が生涯を通じて動的に制御されるかどうか、またはどのように制御されるかはまだ分かっていない。 齧歯類の研究から、成人期でも中枢神経系全体に新しいオリゴデンドロサイトが生成されることが示されており(Young et al.、2013)、ヒトの成人脳にもOPCが存在している(Chang et al.、2000)。 ヒト組織の炭素年代測定分析により、大脳皮質内の成体生まれのオリゴデンドロサイトが同定されたが、同じ分析により、脳梁のオリゴデンドロサイトの大部分は幼児期に発生することが示された(Yeungら、2014年)。 しかし、白質構造変化と課題学習を相関させるヒトの神経画像研究は、生涯を通じて新しいミエリンが形成され得ることを示唆している。 このような長期の髄鞘形成は、個々の髄鞘形成オリゴデンドロサイトが新しい鞘の形成を開始するのにわずか数時間という限られた時間枠を持ち(Watkinsら、2008;Czopkaら、2013)、オリゴデンドロサイトあたりの鞘数が時間と共に安定して見えることから、原則として生涯にわたるオリゴデンドロサイト生産を必要とすると思われる(Tripathiら、2017)。 MountとMonje(2017)が指摘した1つの注意点は、炭素年代測定実験における「誕生」日(細胞分裂中のDNA複製の時点を特定する)は、必ずしも分化したオリゴデンドロサイトではなく、OPCのそれを反映していることである。 少なくともげっ歯類では、OPCは細胞分裂せずに直接オリゴデンドロサイトに分化することができるという証拠から、このことは重要です(Hughesら、2013)。 脳梁のOPCは、終末細胞分裂の何年も後にオリゴデンドロサイトに直接分化し得る。したがって、これらの新しいオリゴデンドロサイトの分化の時期は、炭素年代測定では決定できないので、Yeungら(2014)は、成人ヒト脳におけるオリゴデンドロサイト生成の速度を過小評価しているのかもしれない。 生涯を通じたCNSの発達に対するオリゴデンドロサイト生成とミエリンリモデリングの相対的貢献について、我々はまだ多くのことを学んでいる。
人生の様々な段階を通じてオリゴデンドロサイト生成、ミエリン形成、ミエリンリモデリングの正確なダイナミクスを完全に理解するには、高解像度での長期的イメージングが標準的アプローチになる。 ここでは、髄鞘形成のダイナミクスを明らかにし始めた最近のin vivoイメージング研究の概要を提供し、そのようなダイナミクスが神経回路機能にどのように影響を与えるかも理解し始めることができるようになる
De novo Myelination
生体内でオリゴデンドロサイトがいかに生成され、マイリンがいかに作られ動的に再形成されるかを明確に取り上げ始めるために、最近の2研究はマウス体性感覚皮質の長期間にわたる反復2光子イメージングを利用した。 Hughesら(2018)は、蛍光標識したオリゴデンドログリア系細胞を持つトランスジェニックレポーターマウスの皮質を、成体初期から中高年(およそP720)までイメージングした。 その結果、オリゴデンドロサイトの集団は拡大を続け、皮質のオリゴデンドロサイト密度は若年成体から中年期にかけてほぼ2倍になることが判明した(図1A)。 これには、皮質のミエリン鞘の数が2倍以上に増えていることが伴っていた。 しかし、オリゴデンドロサイトの数はどのようにして増えるのだろうか? 出生後の初期発生では、多くのオリゴデンドロサイトが産生されるが、軸索を髄鞘化するのはごく一部の生き残りである (Barres et al., 1992)。 これは成人期でも同様のようで、成人大脳皮質の個々の皮質OPCを最長50日間追跡することにより、Hughesら(2018)は、新たに分化したオリゴデンドロサイトの大部分が細胞死を起こし、わずか22%が生存して髄鞘形成にコミットしていることを明らかにした(図1B)。 新たに分化したオリゴデンドロサイトのどのような割合が、OPCの分裂と直接の分化に続いて生成されるかは、依然として不明である。 しかしながら、オリゴデンドロサイトが一旦髄鞘形成に移行すると、50日間のイメージング期間中に髄鞘形成オリゴデンドロサイトが細胞死を起こした形跡はなく、安定した状態を維持した。 哺乳類大脳皮質における生涯を通じたオリゴデンドロサイトとミエリンの動態。 (A)オリゴデンドロサイト前駆細胞(OPC)は、誕生から中年期まで体性感覚皮質で新しいミエリン化オリゴデンドロサイト(OL)を継続的に生成している。 その後、老年期になるとOLは減少し、ミエリン被覆率も減少する。 (B)単一OPCの系統追跡から、髄鞘形成前のOLは成人期にも継続的に産生されるが、髄鞘形成まで生き残るのは約20%であることがわかった。 一旦形成されたミエリン鞘の多くは、長期間にわたって長さが安定しており、通常、既存のミエリンにはほとんどリモデリングが起こらないことがわかる。 Hillら(2018)およびHughesら(2018)のデータの概要<8617><7892><9037>同様に、Hillら(2018)は、オリゴデンドロサイトのトランスジェニックレポーターおよびラベルフリー分光共焦点反射(SCoRe)顕微鏡技術を用いて、幼体、若齢、中年および老齢マウス(P950)の体性感覚皮質における軸索(Schainら, 2014)に沿ったミエリンを画像化した。 また、成体ではP650までオリゴデンドロサイトの数が拡大し続けること、中年では80日の撮像までオリゴデンドロサイトが安定していることを見出した。 大脳皮質の髄鞘化も中年期のP650でピークを迎え、オリゴデンドロサイトの密度はそのピーク(P650)から超高齢期(P950)にかけて著しく低下することを見出した(図1A)。 このことは、P650からP950の間に皮質I層軸索のミエリン被覆が減少していることに反映されている。 長期的なオリゴデンドロサイトの生存は、CNSの異なる部分間で異なる可能性がある。 Tripathiら(2017)は、マウスのP60でミエリン化オリゴデンドロサイトを標識し、いくつかのCNS領域でP605までどれだけの標識細胞が生存しているかを数えた。 その結果、脊髄と運動野ではP60標識細胞の60~70%が生き残ったのに対し、脳梁ではP60標識細胞の90%以上が生き残っていた。 加齢に伴って中枢神経系のある領域でオリゴデンドロサイトの数が減り、髄鞘が減少することは、加齢に伴う認知機能低下における髄鞘の喪失の役割について、興味深い問題を提起するものである。 MRI解析は、白質微細構造が流動性知能と相関することを示しているが(Ritchieら、2015)、この白質微細構造は年齢が上がるにつれて悪化することも示している(Coxら、2016)。 その後の加齢に伴うミエリンの減少が、ミエリン回路の調節障害による認知機能の低下につながる可能性があります。
成人の大脳皮質における新しいオリゴデンドロサイト(およびそれに続く新しいミエリン)の生成は、回路活動に反応する可能性がありますか? これまでの研究で、マウスからひげを除去して感覚入力を減らすと、体性感覚野のオリゴデンドロジンが減少することが示されている(Hill et al.、2014)。 これをさらに調べるために、Hughesら(2018)は、成体(P365)マウスに3週間、動物ケージにビーズをぶら下げて感覚刺激を与え、ひげを繰り返し刺激し、体性感覚皮質を刺激しました。 3週間の前後で体性感覚野をイメージングすることで、感覚刺激がオリゴデンドロサイトの数を増加させ、新しく分化した細胞の生存が増加する可能性があることを実証しました。 Kougioumtzidouら(2017)は、回路活性が細胞生存の調節に重要である可能性があるというさらなる証拠を提供しました – 彼らは、OPCにおけるAMPA受容体サブユニット2、3、4の損失がオリゴデンドロサイトの生存を減少させることを実証しました。 このことは、新生髄鞘が生涯を通じて皮質回路の活動によって調節され、おそらく同じ回路の機能を微調整することができることを示唆している。 神経細胞の活動は、髄鞘形成中のオリゴデンドロサイトの長期生存を促進するのだろうか。 老年期のオリゴデンドロサイトの減少は、加齢に伴う神経活動の低下によるものであり、その結果、オリゴデンドロサイト全体の生存率に影響を与える可能性がある。 あるいは、オリゴデンドロサイトの寿命は、神経細胞の活動とは無関係に(内因的にプログラムされているか、加齢に伴う他の外因的シグナルの影響を受けて)制限されているのかもしれない。 いずれの場合も、回路刺激は、既存のオリゴデンドロサイトの生存を促進するか、あるいは新しいオリゴデンドロサイトの産生を刺激することによって、加齢に伴うミエリンの減少を緩和するのに役立つ可能性がある。
活動性を介したオリゴデンドロサイトの新生は体性感覚野に限定されません。運動学習中の若年成体マウスは、運動野で新たに分化したオリゴデンドロサイトの数の増加も示しています(Xiao et al.) CNSの他の領域はどうでしょうか? 皮質の軸索の多くは脳梁を経由して投射しているので、皮質回路を刺激すると皮質と脳梁の両方のOPCにシグナルが届く可能性があります。 2つのげっ歯類の研究で、皮質ニューロンの刺激が脳梁内のオリゴデンドロンを誘導することが実証されています。 Gibsonら(2014)は、運動前皮質のV層投射ニューロンを光遺伝的に刺激し、運動前皮質と脳梁の両方でOPC増殖の上昇を見いだしました。 これにより、刺激後4週間でオリゴデンドロサイトの数と鞘の厚さが増加しました。 さらに最近、Mitewら(2018)は、デザイナーズドラッグによって排他的に活性化されたデザイナーズレセプターを用いて体性感覚神経層2/3を刺激し、幼若マウスと成体マウスの両方で、OPC増殖、オリゴデンドロサイト形成、および脳梁の厚い髄鞘の増加も観察されました。 さらに、新しいオリゴデンドロサイトは、活動中の軸索に優先的にミエリン鞘を形成することも明らかにした。 このことは、活動によって誘導されるde novoミエリン化は、原則として、活動中の軸索/回路をターゲットにできることを示している。 しかし、神経活動に伴うミエリンの変化が、どの程度長く続くかは、まだわかっていない。 Tripathiら(2017)、Hillら(2018)、およびHughesら(2018)が指摘した髄鞘形成細胞の長期生存は、オリゴデンドロサイトがいったん髄鞘を形成すると、神経細胞の活動レベルがベースラインに戻っても生き残る可能性があることを示唆している。 神経細胞活動が通常レベルに戻るとミエリン鞘自体が変化するかどうかは、個々の鞘の動態をもっと調べる必要があるが、それについては後述する。
したがって、髄鞘形成に適した軸索が未髄鞘の空間を十分に持っている多くのCNS領域で、生涯にわたってde novo髄鞘形成が起こる可能性がある。 しかし、ヒトの成体脳の様々な領域で、どの程度まで乏突起形成が続いているかは、まだ不明である。 炭素年代測定法では、脳梁路のほとんどのオリゴデンドロサイトが幼少期に生成されることが示唆されています(Yeung et al.、2014)。 新規分化オリゴデンドロサイトの新規マーカー(BCAS1)を用いたヒト脳組織の免疫組織化学的解析では、中年以降も前頭皮質に新規オリゴデンドロサイトが存在するが、生後3年以降の白質には新規オリゴデンドロサイトが極めて少ない(Fard et al.、2017年)。 このような種間のオリゴデンドロジェネシスの違いは、スケールの結果である可能性がある。 Hughesら(2013)のげっ歯類のデータは、オリゴデンドロサイトが膨大に過剰に生成され、ほぼ80%の細胞が連続的に剪定されることを示唆している。 このようなプロセスのエネルギーコストを考えると、人間の脳のような大きさの器官において、このメカニズムは生涯を通じて持続可能なのだろうか? おそらく、ヒトの脳ではオリゴデンドロサイトの過剰生産は限られており、より大きな中枢神経系でより長期の髄鞘形成が必要なためか、あるいは、神経活動などのシグナルがOPCを刺激して、必要なときにオリゴデンドロサイトに分化させるためなのだろう。 既存のミエリン鞘の長さを変えることで、軸索に沿ったミエリン被覆やランビエの節間の距離を変えることができる(これらはいずれも伝導速度に影響を与えるだろう)。 さらに、非常に微細なミエリンの再形成でも、結節の長さそのものを変化させる可能性がある。 最近、視神経と大脳皮質で節の長さが広範囲に変化することが示され、軸索に沿った節の長さを変えることで、原理的に伝導速度も大きく変化させることができます(Arancibia-Cárcamo et al.、2017)。 ランビエの節の変化が主に髄鞘化または軸索自体の再編成によって駆動されるかどうかは、まだ決定されていない
Hillら(2018)およびHughesら(2018)は、鞘長が動的に制御されるかどうかを評価するために、マウス体性感覚皮質の個々の髄鞘の数週間にわたる経時研究を実施した。 Hillら(2018)は、成体初期(P90-120)において、一部の鞘は伸長や収縮を示すものの、観察された鞘の81%は安定していることを明らかにした。 より多くの鞘が年齢とともに長さが安定する可能性がある;Hughesら(2018)は、高齢(P365)動物の鞘を追跡し、99%の鞘が3週間にわたって安定したままであることを見た(図1B)<8617><9037>同様の鞘長の安定性はまた他の場所で記載されている;Auerら(2018)は幼生ゼブラフィッシュを用いて、蛍光標識した髄鞘の時間経過ライブイメージングを行って個々の鞘が経時的に長さに変わりうるかどうかを調査した。 彼らは、個々の鞘が形成後の最初の数日間で、鞘の長さを安定させる前に、急速だが可変的な成長を遂げることを見出した。 一旦安定すると、鞘は動物の全体的な成長に合わせて成長し続けます。
なぜ大脳皮質の鞘の中には長さが変わるものと変わらないものがあるのでしょうか。 これは、異なる神経回路の要求の多様性を反映しているのかもしれない。 軸索の多様性は、ゼブラフィッシュの脊髄の初期髄鞘化中に観察されており、一部の軸索はシナプス小胞の放出を利用して髄鞘の数と長さを調節するが、他の軸索は調節しない(Koudelka et al.、2016年)。 このことから、一部の軸索のみが活動関連シグナルを介してミエリンを制御することができるという興味深い仮説が浮かび上がりました。 Hughesら(2018)は、彼らの感覚刺激パラダイムが体性感覚皮質における動的鞘の割合を増加させないことを発見しました。 しかし、鞘長動態の縦断的研究と組み合わせた軸索サブタイプの多様性に関するより詳細な分析により、鞘長リモデリングが特定の回路に特異的であるかどうかを確認できるだろう
Does sheath length stability reflect a inability of sheath to remodel? ゼブラフィッシュの実験では、軸索の髄鞘プロファイルが破壊されると、鞘長リモデリングが誘発されることが示唆されている。 Auerら(2018)は、単一のオリゴデンドロサイトを切除し、したがって軸索に沿った鞘をまばらに除去しました。 彼らは、完全に髄鞘化された軸索上で単一の髄鞘が失われた場合、隣接する鞘は髄鞘化されていないギャップをカバーするために急速な成長を再開できることを発見した。 いくつかのケースでは、前任者の代わりに新しいミエリン鞘が形成され、侵入してきた隣の鞘を押し返して、元の髄鞘パターンを復元することさえできた(図2A)。 したがって、ミエリン破壊後でも、特定の髄鞘パターンが優先的に維持されることがある。 これは、下にある軸索の最適化された伝導特性を維持するためかもしれません。 Auerら(2018)は、齧歯類の大脳皮質で以前に確認されたように、幼生ゼブラフィッシュでまばらに髄鞘化された軸索を観察した。 興味深いことに、彼らは、そのようなまばらに有髄化された軸索の単一の鞘を切除すると、軸索のそうでなければ無髄化されたストレッチに沿ってさえ、切除した鞘と実質的に同じ場所に新しい鞘が形成されることを見出した(図2B)。 したがって、齧歯類のHillら(2018)が示唆したように、疎性有髄軸索に沿った有髄パターンも、ゼブラフィッシュでは安定的に維持されるようである。 疎な髄鞘形成プロファイルの機能はまだ不明である。 そのようなパターンは、動物の成長および/または軸索の長さの変化に応じて、回路内の一貫した伝導時間を維持するために、そのような無髄化ギャップが徐々に有髄化を促進する可能性もあるが、時間の経過とともに単一軸索機能をよりダイナミックに微調整することが可能である
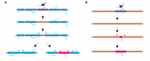
FIGURE 2. ミエリンのリモデリングはin vivoで起こりうる。 (A)完全に髄鞘化された軸索上の単一鞘を切除すると、その隙間を埋めるために隣接する鞘の急速な成長が引き起こされることがある。 この隙間は、隣接する鞘によって完全に覆われるか、あるいは新しい鞘の追加によって元の髄鞘プロファイルが復元されるかのいずれかである。 (B)まばらに髄鞘が形成された軸索の鞘を切除すると、切除された前の鞘と同じ大きさと位置の新しい髄鞘が形成される。 Auerら(2018)のデータの要約.
哺乳類の安定した髄鞘も、髄鞘パターンが破壊されたときにリモデルするこの能力を持っているのだろうか? この問いに答えるには、脱髄と組み合わせたさらなる縦断的研究が必要である。 このようなリモデリングは、神経細胞の活動によって誘導されるのではなく、ミエリン喪失の代償機構である可能性もある。 加齢に伴うオリゴデンドロサイトの減少が、生き残った鞘のリモデリングを引き起こし、軸索の変性した部分を覆うことで、回路の機能維持に役立っているのかもしれない。
ここで取り上げたライブイメージング研究はすべて、ミエリン鞘の長さのダイナミクスを評価しているが、ミエリン鞘の厚さを評価しているわけではない。 鞘の厚さは動的に調節できるのだろうか。 成体マウスのオリゴデンドロサイトでPI3K/AKT/mTORシグナルを刺激すると、ミエリンの巻きつきが追加され、鞘の厚みが増す(Snaideroら、2014)。 これは、神経細胞刺激が幼若マウスと成体マウスの両方で鞘の厚さの増加につながるため、回路活動によって調節される可能性があります(Gibsonら、2014年; Mitewら、2018年)。 このことは、鞘リモデリングのダイナミクスを完全に理解するために、すべての鞘パラメータを縦断的に画像化する必要性を強調している。 現在、軸索に沿った鞘の厚さを正確に測定するためには、電子顕微鏡による断面測定が必要であり、これは解析を単一の時間点に制限するため、ライブイメージング様式が必要である。 第3高調波発生顕微鏡や分光反射率測定法などのいくつかのラベルフリーイメージング技術は、そのような測定の実行に有望である(Limら、2014年;Kwonら、2017年)。 これらの技術をげっ歯類大脳皮質の縦断的研究と組み合わせることで、確立されたミエリン鞘がその厚さを調整できるかどうか、または神経細胞の活動が単にデノボ髄鞘を押し出して厚い鞘を生成するかどうかを明らかにできるだろう。
したがって、ミエリンが破壊されるとミエリン鞘は再形成できるものの、ほとんどの鞘は一般的に長さが安定であると考えられる。
今後
最近の哺乳類のイメージング研究では、皮質灰白質におけるde novo髄鞘と鞘のリモデリングに焦点が当てられている。 皮質回路は脊髄や脳梁などの多くの領域を介して情報を受発信するため、複数の異なるCNS領域における髄鞘の変化が一つの回路におけるシグナル伝達を変化させる可能性がある。 CNSは従来、ホルムアルデヒド固定後の外観で表現され、「白質」は髄鞘の多い軸索路を、「灰白質」は神経細胞体、樹状突起、シナプスが密に詰まった領域を表していた。 しかし、この分類は単純すぎる。OPCは、灰白質および白質の両方で有髄化オリゴデンドロサイトを生成し(Dawsonら、2003)、実際、灰白質および白質の両方でオリゴデンドログリア系譜および有髄化のパターンにおける多様性の証拠が現れている(Riversら、2008;Viganòら、2013;Youngら、2013;Bechlerら、2015)。 このような多様性は、CNSの異なる領域、そして潜在的には異なる回路におけるミエリンの独自の要件を反映しているのかもしれない。 大脳皮質以外のCNSの領域におけるde novo髄鞘および鞘リモデリングのダイナミクスをより理解するために、さらなる縦断的イメージング研究が必要である<8617><9037>幼生ゼブラフィッシュの光学的透明性は、非侵襲的ライブイメージングに適しているが、哺乳類のCNSでそのような実験を行うことはより侵略的で技術的に困難である。 Hillら(2018)およびHughesら(2018)は、頭蓋イメージングウィンドウを有する二光子顕微鏡を利用して、大脳皮質に400μmまでの深さを画像化した。 同様の技術は、脊髄の表在髄路を経時的に画像化するために使用することができるが(Locatelliら、2018)、より深いCNS領域は二光子顕微鏡法だけでは浸透することができない。 代替案の1つは、2光子マイクロ内視鏡を使用することで、勾配屈折率(GRIN)レンズを備えたマイクロ内視鏡プローブを組織に挿入し、脳のより深い場所にある細胞を画像化することです 。 しかし、内視鏡の挿入は、髄鞘形成に影響を与える可能性のある炎症反応を引き起こす可能性がある。 代替案としては、以前に海馬の画像化にも使用された頭蓋イメージングウィンドウ法を用いた3光子顕微鏡が考えられます(Hortonら、2013年;Ouzounovら、2017年)。 3光子顕微鏡は、2光子顕微鏡よりも有意に大きな信号対バックグラウンド比を与えるため、より深い組織構造の画像化に使用することができる
異なるCNS領域だけでなく、これらの領域内の異なるニューロンを考慮することが特に重要である。 以前の研究では、異なるニューロンサブタイプが髄鞘を調節する方法に機構的な違いがあることが示唆されている(Koudelka et al.、2016)。 さらに、ミエリンの局所的な調節にも多様性がある可能性があります。 CNSの異なる部位は別個の存在ではなく、相互につながっていることを忘れてはならない。 異なる領域にわたる異なるニューロンサブタイプの接続の理解に焦点を当てたメソスケールコネクトミクスを統合することは(Zeng、2018)、生涯ミエリン動態が異なる回路間でどのように変化するかを理解する上で極めて重要となるであろう<8617><9037>異なる回路に沿ってミエリン制御の機能的結果は何であろうか。 これまでのところ、機能的な意味は行動との相関によってのみ推論できる。 最終的には、ミエリン動態の測定と回路活動の直接評価を組み合わせる必要がある。 そのためには、ミエリン形成の縦断的研究中に神経細胞の活動を記録し、観察されたデノボミエリン形成やシースリモデリングを、時間とともに変化する回路機能に直接関連付ける必要がある。 個々の神経細胞や軸索のミエリン動態や電気生理学的活動を測定し、ミエリン鞘の様々なパラメータの変化が、単一細胞レベルでの伝導特性に実際にどのように影響するかを明らかにするとともに、集団レベルでの活動を評価することが重要であろう。 遺伝的にコード化されたCa2+または電圧インジケータなどのツールは、回路活動の比較的非侵襲的な記録を可能にし、全脳回路活動の評価に使用することさえできる(Ahrensら、2012;Lovett-Barronら、2017)
結論
軸索の髄鞘化は生涯を通じて回路機能を調節する強力な潜在的メカニズムを表している。 研究では、大脳皮質におけるde novo髄鞘化(新しいオリゴデンドロサイトの産生を介して)が成人期でも起こり、これは回路活動を刺激することによって強化できることが実証されている。 ミエリンは一度形成されると安定で、オリゴデンドロサイトの交代も少なく、既存のミエリン鞘の長さの変化も限定的である。 しかし、これらの安定した構造は、ミエリンが乱された場合、リモデリングする能力を保持する可能性がある。 このことは、傷害、疾病、老齢期の回路機能維持におけるミエリンの可塑性に関して、興味深い示唆を与えている。 髄鞘の変化がどのように回路の機能に影響を与えるかは、まだわかっていない。 最終的には、ミエリン動態の解析と回路機能の直接測定を統合した回路レベルのアプローチが、動的髄鞘が生涯を通じて神経系全体の機能にどのように影響するかを十分に理解するために必要である」
Author Contributions
記載されたすべての著者は、この研究に対して実質的、直接的、知的貢献を果たし、出版を承認した。 JMWはエジンバラ大学博士課程組織修復学生賞(MRC Doctoral Training Partnership MR/K501293/1)とウェルカムトラスト組織修復4年博士課程プログラム(Grant 108906/Z/15/Z)の支援を受けている。
利益相反声明
著者らは、本研究が利益相反の可能性と解釈される商業的または金銭的関係がない状態で行われたことを宣言する
Ahrens, M. B.., Li, J. M., Orger, M. B., Robson, D. N., Schier, A. F., Engert, F.、他 (2012). ゼブラフィッシュの運動適応における脳全体のニューロンダイナミクス。 Nature 485, 471-477.1038/nature11057
PubMed Abstract | CrossRef Full Text | Google Scholar
Almeida, R.G., and Lyons, D.A. (2017). 有髄軸索の可塑性とニューロン回路の形成と機能について。 J. Neurosci. 37, 10023-10034. doi: 10.1523/JNEUROSCI.3185-16.2017
CrossRef Full Text | Google Scholar
Arancibia-Cárcamo, I.L., Ford, M.C., Cossell, L., Ishida, K.Tohyama, K., and Attwell, D. (2017). Node of Ranvier length as a potential regulator of myelinated axon conduction speed. eLife 6:e23329. doi: 10.7554/eLife.23329
PubMed Abstract | CrossRef Full Text | Google Scholar
Auer, F., Vagionitis, S., and Czopka, T. (2018). in vivoイメージングで明らかになったCNSにおけるミエリン鞘のリモデリングのエビデンス。 Curr. Biol. 28, 549-559. doi: 10.1016/j.cub.2018.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Barres, B. A., Hart, I. K., Coles, H. S. R., Burne, J. F., Voyvodic, J. T., Richardson, W. D., et al. (1992). オリゴデンドロサイト系における細胞死と細胞生存の制御。 Cell 70, 31-46. doi: 10.1016/0092-8674(92)90531-G
CrossRef Full Text | Google Scholar
Bechler, M. E., Byrne, L., and Ffrench-Constant, C. (2015)(2015. CNSのミエリン鞘の長さはオリゴデンドロサイトの固有特性である。 Curr. Biol. 25, 2411-2416. doi: 10.1016/j.cub.2015.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, A., Nishiyama, A., Peterson, J., Prineas, J., and Trapp, B.D. (2000). 成人ヒト脳および多発性硬化症病変におけるNG2陽性オリゴデンドロサイト前駆細胞。 J. Neurosci. 20, 6404-6412. doi: 10.1523/JNEUROSCI.20-17-06404.2000
PubMed Abstract | CrossRef Full Text | Google Scholar
Cox, S. R., Ritchie, S. J., Tucker-Drob, E. M., Liewald, D. C., Hagenaars, S. P., Davies, G., et al(2016).の項参照。 UK Biobank参加者3,513名における加齢と脳白質構造。 Nat. Commun. 7:13629. doi: 10.1038/ncomms13629
PubMed Abstract | CrossRef Full Text | Google Scholar
Czopka, T., Ffrench-Constant, C., and Lyons, D. A. (2013). 個々のオリゴデンドロサイトは、in vivoで新しいミエリン鞘を生成するのに数時間しかない。 Dev. Cell 25, 599-609. doi: 10.1016/j.devcel.2013.05.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Dawson, M. R. L., Polito, A., Levine, J. M., and Reynolds, R.(2003年). NG2発現グリア前駆細胞:成体ラットCNSにおける豊富で広範な循環細胞集団。 Mol. Cell. Neurosci. 24, 476-488. doi: 10.1016/S1044-7431(03)00210-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Fard, M. K., Van der Meer, F., Sánchez, P., Cantuti-Castelvetri, L., Mandad, S., Jäkel, S.他 (2017).Onc. BCAS1の発現は、多発性硬化症病変における早期髄鞘形成オリゴデンドロサイトの集団を規定する。 Sci. Transl. Med. 9:eaam7816. doi: 10.1126/scitranslmed.aam7816
PubMed Abstract | CrossRef Full Text | Google Scholar
Fields,R. D. (2015). 神経系可塑性の新しいメカニズム:活動依存性髄鞘形成。 Nat. Rev. Neurosci. 16, 756-767. doi: 10.1038/nrn4023
PubMed Abstract | CrossRef Full Text | Google Scholar
Ford, M. C., Alexandrova, O., Cossell, L., Stange-Marten, A., Sinclair, J., Kopp-Scheinpflug, C., et al(2015).参照。 有髄軸索におけるランビエ節と節間特性のチューニングによる活動電位のタイミング調整。 Nat. Commun. 6:8073. doi: 10.1038/ncomms9073
PubMed Abstract | CrossRef Full Text | Google Scholar
Gibson, E.M., Purger, D., Mount, C.W., Goldstein, A.K., Lin, G.L., Wood, L.S., et al. (2014). 神経細胞の活動は、哺乳類の脳におけるオリゴデンドロンの形成と適応的な髄鞘形成を促進する。 Science 344:1252304. doi: 10.1126/science.1252304
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Li, A. M., and Grutzendler, J. (2018)(2019). 生きた哺乳類脳における生涯皮質ミエリンの可塑性と加齢に伴う変性。 Nat. Neurosci. 21, 683-695. doi: 10.1038/s41593-018-0120-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Patel, K. D., Goncalves, C. M., Grutzendler, J., and Nishiyama, A. (2014). NG2細胞分裂後の重要な時間窓におけるオリゴデンドロサイトの生成の調節。 Nat. Neurosci. 17, 1518-1527. doi: 10.1038/nn.3815
PubMed Abstract | CrossRef Full Text | Google Scholar
Horton, N. G., Wang, K., Kobat, D., Clark, C. G., Wise, F. W., Schaffer, C. B., and al. (2013). 無傷のマウス脳内の皮質下構造のin vivo 3光子顕微鏡観察。 Nat. Photonics 7, 205-209. doi: 10.1038/NPHOTON.2012.336
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, B., Wei, W., Wang, G. , Gaertig, M. A. , Feng, Y., Wang, W. , et al. (2015). 変異ハンチンチンはミエリン制御因子を介したミエリン遺伝子発現をダウンレギュレートし、成熟オリゴデンドロサイトに影響を与える。 Neuron 85, 1212-1226. doi: 10.1016/j.neuron.2015.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Kang, S. H., Fukaya, M. and Bergles, D. E. (2013). オリゴデンドロサイト前駆細胞は、成体脳において成長と自己抑制のバランスを取りながらホメオスタシスを達成している。 Nat. Neurosci. 16, 668-676. doi: 10.1038/nn.3390
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., and Bergles, D. E. (2018).漸近的に変化しているオリゴデンドロサイトの成長。 成体体性感覚皮質における経験依存的な乏突起形成によるミエリンリモデリング。 Nat. Neurosci. 21, 696-706. doi: 10.1038/s41593-018-0121-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Jung, J. C., Mehta, A. D., Aksay, E., Stepnoski, R., and Schnitzer, M. J. (2004). 一光子および二光子蛍光マイクロ内視鏡を用いたin vivo哺乳類脳イメージング。 J. Neurophysiol. 92, 3121-3133. doi: 10.1152/jn.00234.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kang, S. H., Li, Y., Fukaya, M., Lorenzini, I., Cleveland, D. W., Ostrow, L. W.、他 (2013). 筋萎縮性側索硬化症における灰白質オリゴデンドロサイトの変性と再生障害。 Nat. Neurosci. 16, 571-579. doi: 10.1038/nn.3357
PubMed Abstract | CrossRef Full Text | Google Scholar
Koudelka, S., Voas, M. G., Almeida, R. G., Baraban, M., Soetaert, J., Meyer, M.P., et al. (2016). 個々の神経細胞サブタイプは、シナプス小胞放出を介したCNS髄鞘形成において多様性を示す。 Curr. Biol. 26, 1447-1455. doi: 10.1016/j.cub.2016.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Kougioumtzidou, E., Shimizu, T., Hamilton, N. B., Tohyama, K., Sprengel, R., Monyer, H.、他 (2017). オリゴデンドロサイト前駆体上のAMPA受容体を介したシグナル伝達は、オリゴデンドロサイトの生存を高めることによって髄鞘形成を促進する。 eLife 6:e28080. doi: 10.7554/eLife.28080.
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, J, Kim, M, Park, H., Kang, B.-M., Jo, Y., Kim, J.-H., et al. (2017). in vivoにおける有髄軸索のラベルフリーナノスケール光学計測。 Nat. Commun. 8:1832. doi: 10.1038/s41467-017-01979-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., and Webb, W.W. (2004). 脳深部組織のin vivo多光子顕微鏡観察。 J. Neurophysiol. 91, 1908-1912. doi: 10.1152/jn.01007.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lim, H., Sharoukhov, D., Kassim, I., Zhang, Y., Salzer, J. L., and Melendez-Vasquez, C. V. (2014). 第三高調波発生顕微鏡によるシュワン細胞髄鞘のラベルフリーイメージング。 Proc. Natl.Acad. Sci. U.S.A. 111, 18025-18030. doi: 10.1073/pnas.1417820111
PubMed Abstract | CrossRef Full Text | Google Scholar
Locatelli, G., Theodorou, D., Kendirli, A., Jordão, M. J. C., Staszewski, O., Phulphagar, K., et al. (2018). 単核食細胞は、多発性硬化症モデルにおいて表現型を局所的に指定し、適応させる。 Nat. Neurosci. 21, 1196-1208. doi: 10.1038/s41593-018-0212-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett-Barron, M., Andalman, A.S., Allen, W.E., Vesuna, S., Kauvar, I., Burns, V.M., et al. (2017). 脳の状態を協調的に調節するための祖先の回路。 Cell 171, 1411-1423. doi: 10.1016/j.cell.2017.10.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Mabbott, D. J., Noseworthy, M., Bouffet, E., Laughlin, S., and Rockel, C. (2006). 小児における認知発達のメカニズムとしての白質成長。 Neuroimage 33, 936-946. doi: 10.1016/j.neuroimage.2006.07.024
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenzie, I. A., Ohayon, D., Li, H., Paes de Faria, J., Emery, B., Tohyama, K.、et al. (2014). 運動技能の学習には、中心髄鞘の活性化が必要である。 Science 346, 318-322. doi: 10.1126/science.1254960
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitew, S., Gobius, I., Fenlon, L. R., McDougall, S. J., Hawkes, D., Xing, Y. L., et al. (2018). 神経細胞活性の薬理学的刺激は、軸索特異的な方法で髄鞘を増加させる。 Nat. Commun. 9:306. doi: 10.1038/s41467-017-02719-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mount,C. W., and Monje,M. (2017). Wrapped to adapt: Experience-dependent myelination. Neuron 95, 743-756. doi: 10.1016/j.neuron.2017.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Ouzounov, D. G., Wang, T., Wang, M., Feng, D. D., Horton, N. G., Cruz-Hernández, J. C., et al (2017). 無傷のマウス脳深部のGCaMP6標識神経細胞の活動をin vivo 3光子イメージングで観察。 Nat. Methods 14, 388-390. doi: 10.1038/nmeth.4183
PubMed Abstract | CrossRef Full Text | Google Scholar
Ritchie, S. J., Bastin, M. E., Tucker-Drob, E. M., Maniega, S. M., Engelhardt, L. E., Cox, S. R., et al. (2015). 晩年における脳白質微細構造と流動性知能の連関した変化。 J. Neurosci. 35, 8672-8682. doi: 10.1523/JNEUROSCI.0862-15.2015
PubMed Abstract | Cross Full Text | Google Scholar
Rivers, L. E., Young, K. M., Rizzi, M., Jamen, F., Psachoulia, K., Wade, A.ら(2008年)。 PDGFRA/NG2グリアは、成体マウスにおいて、髄鞘形成オリゴデンドロサイトおよび梨状突起ニューロンを生成する。 Nat. Neurosci. 11, 1392-1401. doi: 10.1038/nn.2220
PubMed Abstract | CrossRef Full Text | Google Scholar
Sampaio-Baptista, C., Khrapitchev, A. A., Foxley, S., Schlagheck, T., Scholz, J., Jbabdi, S.、その他(2013). 運動技能の学習は、白質微細構造と髄鞘の変化を誘発する。 J. Neurosci. 33, 19499-19503. doi: 10.1523/jneurosci.3048-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Scantlebury, N., Cunningham, T., Dockstader, C., Laughlin, S., Gaetz, W., Rockel, C., et al.(2014).運動技能の学習は、白質微細構造と髄鞘の変化を引き起こす。 小児期における白質成熟と反応時間との関係。 J. Int. Neurophsychol. Soc. 20, 99-112. doi: 10.1017/S1355617713001148
PubMed Abstract | CrossRef Full Text | Google Scholar
Schain, A.J., Hill, R. A., and Grutzendler, J. (2014). スペクトル共焦点反射顕微鏡を用いた健康と疾患における有髄軸索のラベルフリーインビボイメージング。 Nat. Med. 20, 443-449. doi: 10.1038/nm.3495
PubMed Abstract | CrossRef Full Text | Google Scholar
Scholz, J., Klein, M. C., Behrens, T. E. J., and Johansen-berg, H. (2009).。 トレーニングは白質アーキテクチャの変化を誘発する。 Nat. Neurosci. 12, 1370-1371. doi: 10.1038/nn.2412
PubMed Abstract | CrossRef Full Text | Google Scholar
Snaidero, N., Möbius, W., Czopka, T., Hekking, L. H. P., Mathisen, C., Verkleij, D., et al.(2014).トレーニングが白質アーキテクチャを変化させる。 PI(3,4,5)P3依存的な舌内側の極性成長によるCNS軸索のミエリン膜ラッピング。 Cell 156, 277-290. doi: 10.1016/j.cell.2013.11.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Takahashi, N., Sakurai, T., Davis, K. L. and Buxbaum, J.D. (2011). 統合失調症におけるオリゴデンドロサイトとミエリンの機能障害と神経回路異常との関連性。 Prog. Neurobiol. 93, 13-24. doi: 10.1016/j.pneurobio.2010.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tomassy, G. S., Berger, D. R., Chen, H.-H., Kasthuri, N., Hayworth, K. J., Vercelli, A.、他 (2014). 大脳新皮質における錐体細胞の単軸索に沿ったミエリン分布の特徴的なプロファイル。 Science 344, 319-324. doi: 10.1126/science.1249766
PubMed Abstract | CrossRef Full Text | Google Scholar
Tripathi, R. B., Jackiewicz, M., Mckenzie, I. A., Kougioumtzidou, E., Grist, M. and Richardson, W. D. (2017). マウスにおける髄鞘形成オリゴデンドロサイトの驚くべき安定性。 Cell Rep. 21, 316-323. doi: 10.1016/j.celrep.2017.09.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Viganò, F., Möbius, W., Götz, M. and Dimou, L.(2013).:。 移植により、成体脳におけるオリゴデンドロサイトの分化の地域差が明らかになった。 Nat. Neurosci. 16, 1370-1372. doi: 10.1038/nn.3503
PubMed Abstract | CrossRef Full Text | Google Scholar
Watkins, T. A., Emery, B., Mulinyawe, S., and Barres, B. A. (2008). 急速に髄鞘が形成されるCNSの共培養システムにおいて、γ-セクレターゼとアストロサイトによって制御される髄鞘形成の異なる段階。 Neuron 60, 555-569. doi: 10.1016/j.neuron.2008.09.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Waxman, S. G.(1980). 有髄神経線維における伝導速度の決定因子。 Muscle Nerve 3, 141-150. doi: 10.1002/mus.880030207
PubMed Abstract | CrossRef Full Text | Google Scholar
Xiao, L., Ohayon, D., Mckenzie, I.A., Sinclair-Wilson, A., Wright, J.L., Fudge, A.D., et al.(2016).の項参照。 運動技能学習の初期段階には、新しいオリゴデンドロサイトの迅速な産生が必要である。 Nat. Neurosci. 19, 1210-1217. doi: 10.1038/nn.4351
PubMed Abstract | CrossRef Full Text | Google Scholar
Yeung, M. S. Y., Zdunek, S., Bergmann, O., Bernard, S., Salehpour, M., Alkass, K., et al(2014).の項をご参照ください。 ヒトの脳におけるオリゴデンドロサイトの生成と髄鞘形成のダイナミクス。 Cell 159, 766-774. doi: 10.1016/j.cell.2014.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Young, K. M., Psachoulia, K., Tripathi, R. B., Dunn, S. -J., Cossell, L., Attwell, D.,など (2013).All Rights Reserved. 健康な成人CNSにおけるオリゴデンドロサイトダイナミクス:ミエリンリモデリングの証拠。 Neuron 77, 873-885. doi: 10.1016/j.neuron.2013.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng、H.(2018).Origin, H. (2013)。 メソスケールコネクトミクス。 Curr. Opin. Neurobiol. 50, 154-162. doi: 10.1016/j.conb.2018.03.003
PubMed Abstract | CrossRef Full Text | Google Scholar
。