通常の臨床検査では、ヘモグロビン評価や赤血球数・指数に特徴的な所見があれば、βサラセミア遺伝子の診断が下されることがほとんどです。 特に、ヘモグロビン(Hb)A2の割合が上昇し、赤血球の平均体積(MCV)および/または平均体積ヘモグロビン(MCH)が低下していることが挙げられる。
βサラセミア形質(βサラセミア小体、βサラセミア保因状態とも呼ばれる)は良性のヘテロ接合性の疾患で、より重症のβサラセミア症候群(中間型および大)と臨床および検査値の特徴によって区別することができる。 中型および大型のβサラセミア症は、貧血の重症度、輸血依存性、脾臓肥大と関連していますが、βサラセミア形質にはこれらの特徴がありません。 重症のβサラセミアでは、Hb Aがないため胎児ヘモグロビン(Hb F)の量が著しく増加し、βサラセミア形質のようにHb A2の量が増加しないこともあります。 ですから、βサラセミア遺伝子の検査診断は比較的簡単なはずですが?
必ずしもそうとは限りません。 5130>
ケース1:競合条件
患者は28歳のアフリカ系アメリカ人女性で、HIV-1感染が陽性で、ドルテグラビル/アラビカビル/ラミブジンのレジメンで高活性抗レトロウイルス療法(HAART)を受けていた。 検査所見は表1に示すとおりである。 症例1の検査結果
この症例は興味深い状況を呈していた。 Hb A2値は有意に上昇していたが、対応するヘモグラムでは、微小青斑症や低色素症は認められなかった。 検査所見でβサラセミア遺伝子の診断がつかない場合,Hb A2値や赤血球指数に影響を与える他の疾患を検討することが有用である。 この症例では、重要な手がかりが患者の臨床歴に見出された。
Hb A2値は、赤血球前駆体の核成熟を遅らせる条件において上昇する傾向がある。 この現象の最も一般的な原因は、葉酸および/またはビタミンB12欠乏による巨赤芽球性貧血である1,2。 しかし、ヌクレオシド系逆転写酵素阻害剤(NRTI)と呼ばれる抗HIV薬など、核酸合成を阻害するいくつかの薬剤にも同様の作用があることが分かっています。
では、この患者のHb A2値が高いのは抗HIV薬のせいであり、患者はβサラセミア形質ではないと結論づけるべきでしょうか。 そうではありません。 一般に、NRTI(または巨赤芽球性貧血)によるHb A2の増加は、βサラセミア形質でみられる増加よりも少ない1,2。さらに、その増加は薬剤の全体的な効果に比例する傾向があり、MCVの増加で近似することができる1,2。 NRTI治療を受けている患者の多くはMCVが著しく高い(しばしば120fLを超える)のに対し、この患者のMCVは基準範囲の下限に達していた。
そのため、この患者の非常に高いHb A2レベルがラミブジン治療だけが原因だとは確信していなかった。 私たちは、この患者がMCVを増加させる条件と減少させる条件(すなわち、それぞれβサラセミア遺伝とラミブジン療法)が競合し、その両方が高いHb A2値に寄与しているのではないかと考えたのである。 我々は発注元の医師に、βサラセミア遺伝子の可能性が高く、βグロビン変異解析で確認できることを報告した。 その後、遺伝子配列解析の結果、β-ゼロサラセミアに関連するヘテロ接合性のβグロビン変異が判明した。
症例2:民族的要因
患者は35歳の妊娠中のベトナム女性で、ヘモグロビン症のスクリーニング検査を受けていた。 検査所見は表2に示すとおりである。 症例2の検査結果
今回もHb A2値が高く、微小青斑症や低色素症が少ない、あるいはないことが不一致であった。 この症例では、葉酸、ビタミンB12、鉄の欠乏、甲状腺機能障害、薬の影響などの一般的な交絡因子を除外することができた。 この患者の民族性から、もう一つの重要な不一致の原因として、αサラセミア小体型と共連れするβサラセミア形質が疑われた。 2
私たちは、妊娠中の母親と胎児へのリスクを十分に評価するために、αおよびβサラセミア変異を検査する遺伝子解析を勧めました。 その後、βグロビンのシークエンスにより、ヘテロ接合性のβプラスサラセミア変異が明らかになり、αグロビン欠失の解析により、ヘテロ接合性の東南アジア(SEA)の2遺伝子欠失が明らかになり、-/ααマイナーサラセミアと一致した。
αおよびβサラセミア
サラセミアは人類に最も多く見られる遺伝性疾患の一つである。 マラリアが流行していた地域では非常に多く、現在では人口移動により世界のあらゆる地域で一般的になっている。 サラセミアは、赤血球前駆体におけるグロビン遺伝子の発現を減少させる変異によって引き起こされる。 この疾患は、変異したグロビン遺伝子(例えば、α型とβ型)によって分類され、変異がヘテロ接合型とホモ接合型/複合ヘテロ接合型のいずれで遺伝するかに関係する疾患の重症度によって分類される。 成人の主なヘモグロビンはHb Aであり、2本のアルファグロビン鎖と2本のベータグロビン鎖の4量体である。 アルファ型サラセミアでは、アルファグロビンの発現が欠損しており、それに伴ってベータグロビン鎖が過剰になる。 グロビン鎖の欠損と不均衡により、赤血球のヘモグロビン量が減少し、小球減少症や低色素症が生じます。 また、過剰なαまたはβグロビン鎖は不安定な4量体を形成し、溶血を引き起こす。 アルファおよびベータサラセミアは、2本のアルファおよび2本のデルタグロビン鎖の4量体であるマイナー成人ヘモグロビンHb A2の量により区別される。 ベータサラセミアは、ベータグロビンが相対的に少ないため、デルタ鎖がより多くヘモグロビンに取り込まれるため、Hb A2が増加する。
ベータサラセミアの原因は、染色体11上のベータグロビン遺伝子座の変異である3、4 。ほとんどの変異は小さな塩基置換、挿入または欠失だが、まれに大きな欠失も確認される。 変異の種類によって、βグロビンの発現が部分的に減少する(βプラスサラセミア)、あるいは完全に減少する(βゼロサラセミア)。 βサラセミア形質はヘテロ接合型変異によって引き起こされます。 この状態は無症状であり、Hb A2の増加、赤血球の微小赤血球増加、著しい溶血性貧血がないことが特徴である。 一方、大βサラセミア(クーリー貧血)は、ホモ接合性のβゼロ変異により発症する。 ヘモグロビン評価では、Hb Fが優位で、Hb Aがなく、Hb A2が正常または増加していることが確認される。 主要なβサラセミアは、重度の輸血依存性溶血性貧血を特徴とし、脾臓腫大と骨変形が生じる。 輸血の繰り返しは鉄過剰症を引き起こし、罹患率と死亡率の主な原因となります。 中間型βサラセミアは臨床的に不均一であり、ほとんどの症状は中等度の溶血性貧血に関連している。 ベータグロビンの発現がないわけではないので、輸血依存症はまれである。 ベータサラセミアに関連する変異の数が多いため、遺伝子診断には通常、遺伝子配列の解読が必要である。 βサラセミア症候群を表3にまとめる。
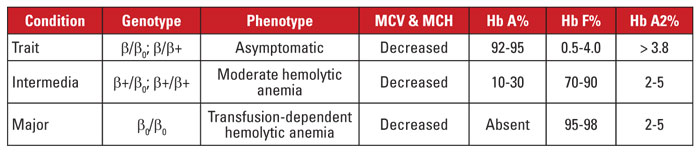
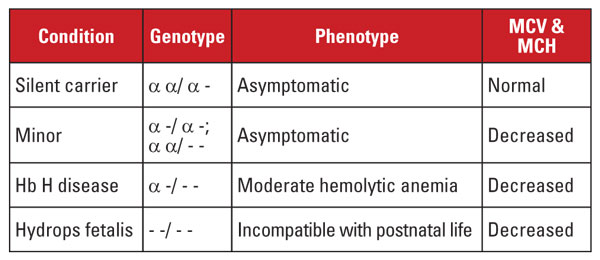
この状態は無症状で、通常は正常な赤血球指標と関連している。 2つのαグロビン遺伝子が失われたものは、αサラセミア小体型と呼ばれる。 この疾患はホモ接合性の1遺伝子欠失またはヘテロ接合性の2遺伝子欠失により発症することがある。 赤血球数および指標はβサラセミア形質と区別がつきませんが、Hb A2値は正常です。 3つのα遺伝子の欠損は、Hb H病と呼ばれる。 (Hb Hはβグロビン鎖の4量体である)Hb H病は典型的には脾臓腫大と骨の変化を伴う中等度の溶血性貧血である。
4つのα遺伝子がすべて失われたものはHb Barts胎児性水腫と呼ばれる(Hb Bartsは胎児性γグロビン鎖の4量体である)。 この状態は生後の生活に支障をきたす。 Hb HとHb Bartsはヘモグロビン評価で同定でき、αサラセミアの出生後診断に一役買っている5
遺伝子診断は通常、一般的な欠失を標的としたギャップポリメラーゼ鎖反応(PCR)アッセイによって達成される。 また、稀な変異を検出するために、アルファグロビン遺伝子の塩基配列の決定も可能である。 αサラセミア症候群を表4にまとめる。
遺伝子検査が必要な場合
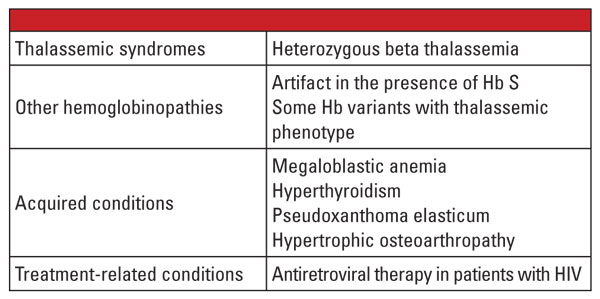
結論として、αおよびβサラセミアのヘテロ接合型は非常によく見られ、臨床検査室で頻繁に確認される。 ヘモグロビン評価やその他の日常的な臨床・検査データで、通常、診断には十分である。 遺伝子検査はほとんどの場合必要ないが、家族計画の観点からは決定的に重要である場合がある。 両親ともにサラセミア変異が確認された場合、胎児が重症のサラセミアを受け継ぐ重大なリスクがある可能性があります。 胎児水腫の場合、胎児死亡の可能性が高く、母体には妊娠合併症の重大なリスクがあります。5 したがって、サラセミアの臨床診断を複雑にする変数に注意し、確認的遺伝子検査の適応となる時期を認識することが重要です。 例えば、最初の症例報告に示されるように、Hb A2のレベルに影響を与える既存の疾患がある場合、βサラセミア遺伝子の診断は困難となることがあります。 Hb A2を増加させることが知られている因子を表5.6
- Steinberg MH, Forget BG, Higgs DR, et al. Disorders of Hemoglobin: Genetics, Pathophysiology Clinical Management.の項を参照。 Cambridge: ケンブリッジ
大学出版局. 2009. - Steinberg MH, Rodgers GP. HbA2:生物学、臨床的関連性、および鎌状赤血球病を改善するための可能なターゲット。 Br J Haematol. 2015;170(6):781-787.
- Cao A, Galanello R. Beta-thalassemia.の項参照。 Genet Med. 2010;12(2):61-76.
- Origa R.β-サラセミア. Genet Med. 2017;19(6):609-619.
- Galanello R, Cao A. Gene test review. α-サラセミア。 Genet Med. 2011;13(2):83-88.
- Stephens AD, Angastiniotis M, Baysal E, et al. ヘモグロビンA2測定のためのISCH勧告. Int J Lab Hematol. 2012;34(1):1-13.