グロースティック(図1参照)が曲げた後、なぜ光るのか不思議に思ったことがありますか? あるいは、あのプラスチックの星は、電気を消した後でも、なぜ夜でも光っているのでしょうか。 無いかもしれませんね。 しかし、そのような疑問を持ったことがあってもなくても、以下の文章は、光るブレスレット、光るクラゲ、ブラックライトなど、さまざまな現象についての答えと説明を提供してくれることでしょう。 グロースティック。
ルミネセンス
一般に、前述したすべての現象で発生する光はルミネセンスと呼ばれるものである。 発光は、物質が光の形で放出するエネルギーである。 発光にはいくつかの種類があり、
- 例えば、化学発光がある。 いくつかの化学反応では、エネルギーが光として放出される。 これは、グロースティックを曲げた後に発生します。 また、クラゲのような動物や一部の微生物が光るのもこのためです。 この場合、バイオ・ルミネッセンス(生物発光)と呼ばれます。 これは、真っ暗闇の中で粘着封筒を開けたり、暗室で粘着テープを広げたりすると観察されます。
- 最も身近な発光は、おそらくフォトルミネッセンス(光ルミネッセンス)でしょう。 ここでは、エネルギーは電磁波、たとえば太陽光や一部のディスコにあるような紫外線ランプによって供給される。 このため、プラスチック製の星が光ったり、白い服がブラックライトで極端に明るくなったりする現象が起こる。
電子的に励起された状態とは?
一般に、あらゆる種類の発光は、いわゆる光物理現象に基づくものです。 通常、分子そのものが蛍光を発すると表現されます。 フルオレセインやクルクミンのような蛍光色素がそうです。
異なる元素の原子は、異なる数の電子をいくつかの殻や軌道に分散して持っています。 電子は素粒子の一種である。 電子遷移は、発光の原因である。 システムがエネルギーを吸収すると、電子は励起され、より高いエネルギーの状態に引き上げられる。 励起前の基底状態では、一部の電子はいわゆるHOMO(Highest Occupied Molecular Orbital)と呼ばれる状態にある。 励起状態になった後は、LUMO(Lowest Unoccupied Molecular Orbital)と呼ばれる状態になります(図2参照)。 具体的にどのように作用するかは、フォトルミネッセンスを具体例として説明する。

図2.フォトルミネッセンス(発光)の例 電子励起。
原子や分子の異なるエネルギー状態は「エネルギー準位」と呼ばれる。 分子や原子によっては、エネルギーが量子化されているため、電子は不連続なエネルギー準位を占めるしかありません。
(1) ΔE = E2-E1
電磁波や光の素となる光子は、あるエネルギー値を持たないと電子を励起することができない。 光子のエネルギーは、hをプランク定数、νを光の周波数とすると、式2で計算できる。
(2) Ephoton = hν
電子に必要な励起エネルギーはエネルギーレベルの差に等しい。 電子を励起できるのは、あるエネルギー、つまりある周波数と波長を持つ光だけである。 式1と式2を等しくし、式3(cは光速)を用いて、必要な周波数と波長を計算する(式4参照)。 多くの場合、励起には紫外線が使用される。
(3) λ = c/ν
(4) ΔE = Ephoton ⇔ E2 – E1 = hν
ν = (E2 – E1)/h
λ = hc/(E2 – E1)
電子励起状態の不活性化
このような電子励起状態は不安定である。 電子は基底状態へと下がっていく。 同時に、励起エネルギーが再び放出される。 放射性崩壊過程と非放射性崩壊過程に区別される。 ほとんどの場合、振動緩和、周囲の分子による消光、内部転換(IC)など、非放射性の崩壊が起こる。 これらの過程は後で詳しく説明します。
蛍光や燐光のような形で放射性崩壊が起こることもあります。 この場合、エネルギーは電磁波や光子として放出されます。 放射された光は、吸収された光よりも波長が長く、エネルギーは低くなりますが、これはエネルギーの一部が非放射性崩壊の過程ですでに放出されているためです。 このため、非可視光である紫外線で励起することにより、可視光域の発光を得ることができる。 この長波長側へのシフトをストークスシフトと呼びます。 蛍光と燐光の比較
蛍光も燐光も電磁波の自発的な放出です。 違いは、蛍光は励起放射源のスイッチを切るとすぐに発光が停止するのに対し、燐光は数秒から数時間にわたる残光が発生します。 電子はいわゆるスピンを持つ粒子で、スピン量子数というものがあります。 電子はいわゆるスピンを持つ粒子で、スピン量子数には+1/2と-1/2の2種類があります。 この数は、実は私たちが簡単に想像したり表現したりできない性質なのです。 よくコマ回しに例えられますが、時計回りか反時計回りのどちらかに回転しています。 しかし、この説明は数学的にも物理的にも全く正しくありません。 原子の1つの軌道にある2つの電子は反平行なスピンを持っており、これを(↓)と表記します。
蛍光
蛍光のJablonski図(図3参照)では、一重項スピン状態S0が電子の基底状態、S1、S2が一重項励起状態(この状態は本文中で例として用いただけなので特定の原子、分子などに必ずしも当てはまるとは限らない)であります。 それらの状態の中に、いくつかのエネルギー準位が存在する。 レベルが高いほど、そのレベルにいるときに電子が持っているエネルギーが大きい。 一重項状態の場合、電子は反平行なスピンを持つ。

図3. 蛍光のJablonski図。
電子は、電磁波で励起されると、例えば基底状態S0から第2励起状態S2のエネルギー準位に持ち上げられる。 励起が停止した後、電子はその励起状態に短時間(約10-15秒)だけ留まり、その後すぐに基底状態への下降を開始する . その際、最初は振動緩和によりエネルギーを周囲に放出することができる。
第二励起状態と第一励起状態の間の大きなギャップは、内部転換によって克服される。 それは、電子のスピンが維持されたまま、2つの状態間の電子遷移を記述するものである。
理論的には、電子は最終的に再び基底状態に到達するまで、非放射性の方法でさらに緩和することができる。 しかし、周囲の分子がこれだけのエネルギーを吸収できないため、最後のエネルギー量が大きすぎて周囲に放出されないということもあり得ます。 このとき、ある波長の光子が放出される蛍光が発生する。 この発光は、電子が基底状態に戻るまでしか続かない。 これらの遷移の間、電子のスピンは変化しないので、スピンを許容すると表現します。
燐光
燐光の場合は少し違います(図4参照)。 やはりS0の基底状態とS1、S2の2つの励起状態があります。 さらに、エネルギー的にS0とS1の間にある励起三重項T1状態もあります。
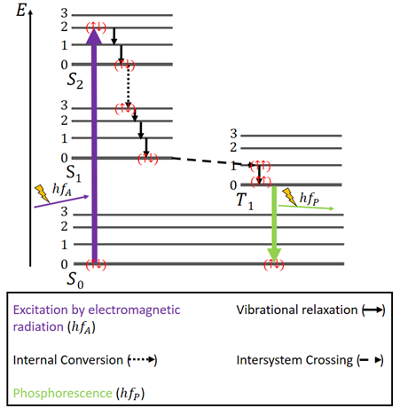
図4.電子は再び基底状態で反平行なスピンを持つ。 燐光のJablonski図。
励起は蛍光と同じように、すなわち電磁波によって起こります。 同じスピンを維持したまま振動緩和や内部転換によってエネルギーを放出するのはここでも同じですが、S1状態に達するまでです。
一重項状態と並行して三重項状態が存在し、S1状態よりT1状態の方がエネルギー的に有利なため、いわゆるシステム間クロス(ISC)が起こりえます。 この交差は内部転換と同様、2つの励起状態間の電子遷移である。 しかし、内部転換とは逆に、ISCは一重項状態から三重項状態へのスピンの反転を伴います。 三重項状態の電子はスピンが平行であり、( )と表記される。 このISC過程は “スピンフォービドゥン “と表現される。 スピン軌道相互作用と呼ばれる現象があるため、完全に不可能というわけではありませんが、可能性は低いでしょう。 しかし、三重項状態の最低エネルギー準位とS0状態との間の遷移は、その遷移もスピン禁制であるため、容易に可能ではありません。 それでも、わずかな可能性ではあるが、とにかく起こりうる。 この場合、電子のスピンを再び反転させなければならないので、かなり弱い光子の放出が起こる。 エネルギーはしばらくの間この状態に閉じ込められ、ゆっくりとしか放出されない。
結論
スピンを許容する過程と禁止する過程は、蛍光の発光がすぐに止まり、燐光の余韻が残る説明として役立ちます。 燐光は通常「重い」分子でのみ起こりますが、これはスピン軌道相互作用によってスピンを反転させなければならないからです。 電磁波が放出されるかどうか、またどの波長で放出されるかは、非放射性崩壊によって事前にどの程度のエネルギーが放出されるかに依存する 。
放射性崩壊の抑制につながるすべてのプロセスは、蛍光消光を引き起こす可能性があります。 例としては、非放射性崩壊プロセスだけでなく、蛍光分子の破壊 . 量子効率はプロセスの効率を表し、吸収された光子と放出された光子の比として定義される。 この特性は物質ごとに異なります。
このテキストではフォトルミネッセンスに焦点を当てていますが、光物理学的プロセスはすべてのタイプのルミネッセンスで同じです。
応用
グロースティックなどの製品以外にも、蛍光やリン光は多くの方法で使用されています。 例えば、非常口への誘導灯は電気が不要ですが、燐光により夜間に光ります。 植物も蛍光を発するようにすることができます。 ほうれん草をナノテクノロジーで加工すると、地下水に含まれる爆発性物質の痕跡を検出できるようになる。 ホウレンソウの葉にはカーボンナノチューブがあり、これにニトロ芳香族化合物を結合させることができる。 ニトロ芳香族が結合すると、植物から蛍光シグナルが放出され、赤外線カメラで検出することができます。 左側は、スパイスのターメリックに含まれるクルクミンという色素の、紫外線下での蛍光を表しています。 クルクミンをアルコールに溶かすことで蛍光が見えるようになります。
プラスチック製のクモと小さな筒の中の化合物は燐光の例です。 チューブの中に入っているアルミン酸ストロンチウムは、紫外線によって初期に励起され、やがて緑色に発光する。 これは、ユーロピウムなどの元素をドーピングして、発光顔料として使えるようにしたためです。
グロースティックを曲げると(右側)、過酸化水素と染料とシュウ酸フェニルの化学反応が始まる。 化学発光が観察できます。
Video 1. 蛍光、燐光、化学発光を比較したものです。
K. Arnold et al., Chemie Oberstufe (in German), Cornelsen Schulverlage, Berlin, 2015, 496-497. ISBN: 978-3-06-011179-4
Lexikon der Physik: Lumineszenz (in German), spektrum.de. (accessed January 25, 2017)
D. Wiechoczek, Wenn Mineralien selber leuchten – Phosphoreszenz, Fluoreszenz und Lumineszenz (in German), chemieunterricht.de 2010. (accessed January 25, 2017)
Lexikon der Physik: Photophysikalische Prozesse (in German), spektrum.de. (accessed January 27, 2017)
D. Wiechoczek, Chemie mit Curry (in German), chemieunterricht.de 2015. (accessed January 27, 2017)
P. W. Atkins, J. de Paula, Kurzlehrbuch Physikalische Chemie (in German), Wiley-VCH, Weinheim, 2008, 853ff., 921ff. ISBN: 978-3-527-31807-0
P. W. Atkins, Physical Chemistry, Oxford University Press, 1994, 591ff.
Quantelung (in German), chemie.de.(ドイツ語)。 (2017年1月27日アクセス)
ボーア振動数関係(ドイツ語), chemgapedia.de. (2017年1月25日アクセス)
イルメナウ工科大学 実践講座 物理化学II 物理化学/マイクロ反応技術 蛍光消光実験(ドイツ語), tu-ilmenau.de. (accessed January 27, 2017)
ストークスシフト(ドイツ語), chemie.de. (accessed January 25, 2017)
Electron spin (in German), chemie.de. (accessed January 27, 2017)
量子収量 (in German), chemie.de. (accessed January 27, 2017)
Spinach detects explosives in groundwater (in German), Spiegel Online, November 1, 2016. (accessed January 27, 2017)
D. Weiß, Phosphorescence (in German), chemie.uni-jena.de. (2017年1月27日アクセス)
 Kim Dreierさんは、ドイツ・レムゴのマリアンヌ・ヴェーバー・ギムナジウム(中等学校)の生徒さんです
Kim Dreierさんは、ドイツ・レムゴのマリアンヌ・ヴェーバー・ギムナジウム(中等学校)の生徒さんです
。