前のセクションでは、異なる元素が単独で存在するか、他の元素と結合して化合物になるかを示しました。 このセクションでは、これらの考えを基に、化学反応をより詳しく見ていきます。
まず、先に説明した水、メタン、二酸化炭素、アンモニアの分子について考えてみましょう。
Question 26
これらの4分子のそれぞれの化学式は何ですか。
答え
それぞれH2O、CH4、CO2、NH3という式である。
本講座で紹介する化合物の化学式は覚える必要はありませんが、上記の4つの分子と水素(H2)、窒素(N2)、酸素(O2)分子の式などいくつか覚えておくと便利でしょう。
次に、水素、炭素、酸素の元素と、メタン、水、二酸化炭素の化合物を含む反応を見てみましょう。 このような反応を化学式で書くと、反応を受ける物質を左側に、反応で生成する物質を右側に置くことになります。
この式は「水素と酸素が水を作る」という単語式で書くこともできますが、少し化学的な省略記法を使うと、次のように書くこともできます:

ここで矢印は「~する」という意味です。

この式は矢印の左側の反応物が右側の生成物に変換されることを示しています。 しかし、この式はどこかおかしい。 何が間違っているかは、反応物と生成物が図で示されている図21を見ればわかります。
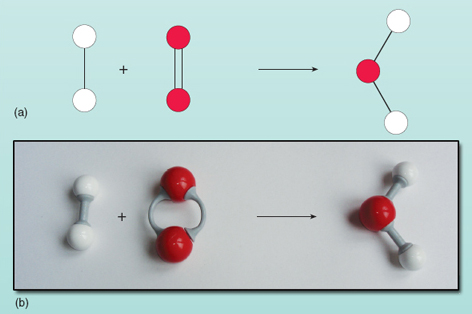
等式の両側の原子の数を数えると、左側には2つの酸素原子があり、右側には1つの酸素原子があることがわかります。 両辺の酸素原子の数は等しくなければなりません。反応中に魔法のように現れたり消えたりすることはありえません。 水分子は2個の水素原子と1個の酸素原子が結合したグループとして存在するので、方程式の右側にある水分子の組成を変えることはできません。 酸素分子はそれぞれ2個の酸素原子を供給するので、反応する水素分子(それぞれ2個の原子を単位とする)が2個あれば、常に2個の水分子を形成する。 したがって、2分子の水を作るには、2分子の水素と1分子の酸素が必要である。

式の両側にある原子の種類は同じ数です。化学式は平衡なので、矢印を等号に置き換えることができます。

これを図22に示します。

化学式は、どの原子と分子が反応して生成物を作るかだけでなく、それぞれの種類の原子と分子がいくつ関係しているかも非常に簡潔な方法で示しています。 分子の前の数字は、その特定の分子の数を意味することを覚えておくことが重要である。
化学方程式は釣り合わなければならない。方程式の両側の、それぞれのタイプの元素の原子数が等しくなければならないのだ。 しかし、化学者は、様々な化学プロセスや反応を記述するための省略記法の一種として、化学式を書くことにも非常に長けている。 化学式の書き方は、外国語の書き方と同じで、流暢に書けるようになるには練習が必要である。 しかし、科学者を目指す人は皆、どこかから始めなければならない。以下のセクションでは、非常に身近な化学反応を使って、その方法を説明する。 このセクションを勉強する必要があるかどうかを確認したい場合は、まず第20問を試してみてください
。