塩の一般的な性質
塩の特徴的な性質として、
- 融点と沸点が挙げられます。 塩は高温で溶けたり沸騰したりする固体である。 塩類は一般に水に溶ける。 例えば、塩化ナトリウム、硫酸カリウム、硝酸アルミニウム、炭酸アンモニウムなどは可溶性塩であるが、塩化銀、塩化鉛、炭酸銅などは水に溶けない。 一般に塩は、その中に水分子が存在する結晶として見出される。 この水を結晶水といい、このような塩を水和塩と呼ぶ。
例えば、硫酸銅の結晶は硫酸銅1分子に対して5分子の水を持っている。 これはCuSO4.5H2Oと表記される。 この結晶の水が結晶に形を与えている。 また、結晶に色をつけるものもあります。 水和塩は加熱すると結晶水を失い、その結果、結晶は形と色を失い、粉末状に変化します。
結晶水を失った水和塩を無水塩と呼びます。 水を加えると、この物質は再び水和硫酸銅の溶液に戻ることができます。
こんな質問もあります
- 塩の分類
- 日常生活におけるさまざまな塩の用途
- 塩の調製
- 可溶塩と不溶塩の調製を説明する
- 定性的に説明する 塩の分析<3670><5315>塩に対する熱の作用<3670><5315>水溶液中のカチオンとアニオンのテスト<3670><5315>連続変化法によるイオン式の構築<3670><5315>化学量論とは何か、なぜ化学で使われるか。
塩の一般的な性質:
1. 酸との反応 : 塩と酸が反応すると、別の塩と酸ができる。 例えば、塩化ナトリウムに硫酸を加えて加熱すると、低温で硫酸水素ナトリウム、高温で硫酸ナトリウムが生成し、塩化水素ガスが発生する
2. 塩基との反応 : 塩は塩基と反応して別の塩と塩基を生成する。
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH
3 金属との反応 : 塩溶液が金属と反応することがある。 例えば、硫酸銅の水溶液に鉄釘を浸すと、銅は釘の表面に析出し、生成した硫酸第一鉄は溶液中に残る。
CuSO4 + Fe → FeSO4 + Cu
この反応は鉄が銅より反応性が高いことを示している。
したがって、反応性の高い金属は、反応性の低い金属をその塩の溶液から追い出すことができます。 塩の水に対する挙動:
塩を水に溶かすと、溶液は中性、酸性、アルカリ性のいずれかになります。 これは使用する塩の性質によるものです。
(i) 強酸と強塩基から得られる通常の塩は中性の溶液を与えます。 例えば、NaClやK2SO4の水溶液はリトマスに対して中性である。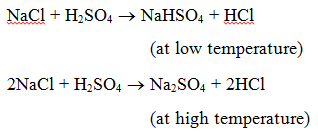
(ii) 弱酸と強塩基から得られる通常の塩は、アルカリ性の溶液になる。 例えば、炭酸ナトリウム(Na2CO3)と酢酸ナトリウム(CH3COONa)の水溶液はアルカリ性です。
Na2CO3 + 2H2O → 2NaOH + CO2 + H2O
CH3COONa + H2O → CH3COOH + NaOH
(iii) 強い酸や弱い塩基から得られる塩は酸性の溶液となる。 例えば、塩化アルミニウム(AlCl3)と塩化アンモニウム(NH4Cl)はともに酸性の水溶液を作る。
AlCl3 + 3H2O → Al(OH)3 + 3HCl
NH4Cl + H2O → NH4OH + HCl
(iv) 酸性塩の溶液はリトマスに対して酸性、すなわち、これらの溶液によって青いリトマス紙は赤く変色する。 例えば、水素硫酸ナトリウム(NaHSO4)の溶液は青いリトマス紙を赤くします。
炭酸水素ナトリウム(NaHCO3)の溶液は、弱アルカリ性です
。