Questa struttura si verifica quando due (o più, ad esempio ψ-loop) segmenti di una catena polipeptidica si sovrappongono e formano una fila di legami idrogeno tra loro. Questo può avvenire in disposizione parallela:

O in disposizione antiparallela:
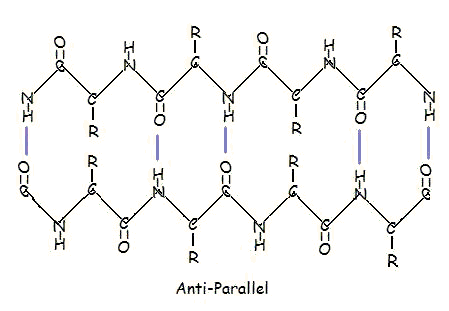
La disposizione parallela e antiparallela è la diretta conseguenza della direzionalità della catena polipeptidica. Nella disposizione antiparallela, l’estremità del C-terminale di un segmento è sullo stesso lato dell’estremità dell’N-terminale dell’altro segmento. In disposizione parallela, l’estremità del C-terminus e l’estremità dell’N-terminus sono sullo stesso lato per entrambi i segmenti. La “piega” si verifica a causa dei piani alternati dei legami peptidici tra gli amminoacidi; l’ammino allineato e il gruppo carbonilico di ogni segmento opposto alternano il loro orientamento da rivolto verso l’altro a rivolto in direzioni opposte.
La disposizione parallela è meno stabile perché la geometria delle singole molecole di amminoacidi costringe i legami idrogeno a verificarsi in un angolo, rendendoli più lunghi e quindi più deboli. Al contrario, nella disposizione antiparallela i legami a idrogeno sono allineati direttamente uno di fronte all’altro, rendendo i legami più forti e più stabili.
Comunemente, un foglio beta-pleato antiparallelo si forma quando una catena polipeptidica inverte bruscamente la direzione. Questo può accadere in presenza di due residui consecutivi di prolina, che creano una piega angolare nella catena polipeptidica e la piegano su se stessa. Questo non è necessario per i segmenti distanti di una catena polipeptidica per formare foglietti beta-pleati, ma per i segmenti prossimali è un requisito definitivo. Per brevi distanze, i due segmenti di un foglio beta-pleato sono separati da 4+2n residui di amminoacidi, con 4 che è il numero minimo di residui.