Proprietà generali dei sali
Alcune delle proprietà caratteristiche dei sali sono:
- Punti di fusione e di ebollizione: I sali sono per lo più solidi che fondono e bollono ad alte temperature.
- Solubilità in acqua: I sali sono generalmente solubili in acqua. Per esempio, il cloruro di sodio, il solfato di potassio, il nitrato di alluminio, il carbonato di ammonio, ecc. sono sali solubili mentre il cloruro di argento, il cloruro di piombo, il carbonato di rame, ecc. sono insolubili in acqua.
- Acqua di cristallizzazione: Generalmente, i sali si trovano come cristalli con molecole d’acqua presenti in essi. Quest’acqua è chiamata acqua di cristallizzazione e tali sali sono chiamati sali idratati.
Per esempio, il cristallo di solfato di rame ha cinque molecole di acqua per ogni molecola di solfato di rame. Questo si scrive come CuSO4.5H2O. Questa acqua di cristallizzazione dà al cristallo la sua forma. Dà anche il colore ad alcuni cristalli. Al riscaldamento, i sali idrati perdono la loro acqua di cristallizzazione e, di conseguenza, i cristalli perdono la loro forma e il loro colore e si trasformano in una sostanza polverosa.
I sali idrati che hanno perso la loro acqua di cristallizzazione sono chiamati sali anidri.
Quando il solfato di rame idrato è riscaldato, cede molecole d’acqua per formare solfato di rame anidro in polvere bianca. All’aggiunta di acqua, questa sostanza può riconvertirsi di nuovo in una soluzione di solfato di rame idrato.
La gente chiede anche
- Classificazione dei sali
- Usi dei diversi sali nella vita quotidiana
- Preparazione dei sali
- Descrivere la preparazione dei sali solubili e insolubili
- Analisi quantitativa dei sali Analisi dei sali
- Azione del calore sui sali
- Test per cationi e anioni in soluzioni acquose
- Costruire equazioni ioniche usando il metodo della variazione continua
- Cos’è la stechiometria e perché è usata in chimica?
Proprietà generali dei sali :
1. Reazione con un acido: quando un sale reagisce con un acido, si forma un altro sale e un altro acido. Per esempio, quando il cloruro di sodio è riscaldato con l’acido solforico, si producono idrogensolfato di sodio (a bassa temperatura) e poi solfato di sodio (ad alta temperatura) e si evolve il gas cloruro di idrogeno.
2. Reazione con una base : Un sale reagisce con una base per produrre un altro sale e un’altra base.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH
3. Reazione con un metallo : A volte, una soluzione salina può reagire con un metallo. Per esempio, quando un chiodo di ferro è immerso in una soluzione acquosa di solfato di rame, il rame si deposita sulla superficie del chiodo e il solfato ferroso formato rimane nella soluzione.
CuSO4 + Fe → FeSO4 + Cu
Questa reazione mostra che il ferro è più reattivo del rame.
Quindi, il metallo più reattivo può spostare un metallo meno reattivo da una soluzione del suo sale.
4. Comportamento dei sali verso l’acqua :
Quando un sale è dissolto in acqua, la soluzione può essere neutra, acida o alcalina. Questo dipende dalla natura del sale usato.
(i) Un sale normale derivato da un acido forte e una base forte dà una soluzione neutra. Per esempio, le soluzioni acquose di NaCl e K2SO4 sono neutre al tornasole.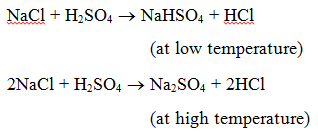
(ii) Un sale normale derivato da un acido debole e una base forte dà una soluzione alcalina. Per esempio, le soluzioni acquose sia di carbonato di sodio (Na2CO3) che di acetato di sodio (CH3COONa) sono alcaline.
Na2CO3 + 2H2O → 2NaOH + CO2 + H2O
CH3COONa + H2O → CH3COOH + NaOH
(iii) Un sale derivato da un acido forte e una base debole dà una soluzione acida. Per esempio, sia il cloruro di alluminio (AlCl3) che il cloruro di ammonio (NH4Cl) danno soluzioni acquose acide.
AlCl3 + 3H2O → Al(OH)3 + 3HCl
NH4Cl + H2O → NH4OH + HCl
(iv) Le soluzioni di sali acidi sono acide al tornasole, cioè, queste soluzioni rendono rossa la cartina tornasole blu. Per esempio, una soluzione di idrogenosolfato di sodio (NaHSO4) fa diventare la cartina di tornasole blu rossa.
La soluzione di idrogenocarbonato di sodio (NaHCO3), invece, è leggermente alcalina.