Introduzione
Il cervello umano subisce una vasta maturazione durante la vita per facilitare lo sviluppo cognitivo. La mielinizzazione degli assoni in tutto il sistema nervoso è uno di questi processi di maturazione cruciali. Nel sistema nervoso centrale (SNC), le cellule gliali chiamate oligodendrociti estendono molti processi nel loro ambiente circostante, che concentricamente avvolgono la membrana intorno agli assoni per formare guaine mieliniche. Le guaine mieliniche permettono la rapida conduzione saltatoria dei potenziali d’azione, localizzando i canali Na+, legati al voltaggio, in brevi spazi tra le guaine adiacenti (conosciuti come i nodi di Ranvier), e agendo come isolanti elettrici. Gli assoni che sono completamente mielinizzati lungo la loro lunghezza conducono gli impulsi molte volte più velocemente degli assoni non mielinizzati della stessa sezione trasversale (Waxman, 1980). Pertanto, i circuiti neurali mielinizzati conducono le informazioni molto più velocemente dei circuiti non mielinizzati. Gli esseri umani nascono con un SNC praticamente non mielinizzato, e la popolazione di oligodendrociti si espande drammaticamente dopo la nascita con una diffusa mielinizzazione nei primi anni dell’infanzia. La mielinizzazione continua durante l’adolescenza e nell’età adulta in un modo spazio-temporale caratteristico, in correlazione con l’emergere e il mantenimento della corretta funzione del circuito. Per esempio, la maturazione della materia bianca (le aree ricche di mielina del SNC) è concomitante con lo sviluppo dei processi cognitivi dell’infanzia, come la velocità di elaborazione delle informazioni (Mabbott et al., 2006; Scantlebury et al., 2014). Inoltre, la patologia/anomalie della mielina sono viste non solo nella malattia demielinizzante Sclerosi multipla, ma anche in diverse malattie neurodegenerative (Kang et al., 2013; Huang et al., 2015) e disturbi del neurosviluppo (Takahashi et al., 2011). Tuttavia, la mielinizzazione dei singoli assoni non è un fenomeno “tutto o niente”. Gli assoni nel sistema nervoso centrale presentano un’ampia variazione nel numero di guaine mieliniche, nella lunghezza delle guaine, nello spessore delle stesse e nella distribuzione lungo la loro lunghezza. Esistono molti modelli diversi di mielinizzazione; per esempio, assoni con regioni scarsamente mielinizzate sono stati descritti nella corteccia di topi giovani e adulti (Tomassy et al., 2014; Hill et al., 2018; Hughes et al., 2018). La modifica di uno qualsiasi di questi parametri della guaina ha effetti prevedibili sulla velocità di conduzione dell’assone sottostante – quindi stabilire un modello specifico di mielinizzazione lungo un assone può essere particolarmente importante per mettere a punto la funzione del circuito. Per esempio, gli assoni nel tronco encefalico uditivo dei gerbilli mostrano guaine mieliniche progressivamente più corte lungo le regioni distali per garantire la precisa tempistica di arrivo del segnale per facilitare la localizzazione del suono (Ford et al., 2015). Sottili cambiamenti nel modello generale di mielinizzazione lungo un assone (sia attraverso l’aggiunta di nuova mielina, o il rimodellamento della mielina esistente) potrebbe cambiare profondamente la tempistica degli impulsi neurali nei circuiti. Se la mielina è adattabile, allora la modifica di tali schemi di mielinizzazione può rappresentare un potente meccanismo di regolazione della funzione del circuito per tutta la vita.
Prove recenti suggeriscono che la mielina può essere adattabile in risposta all’attività del circuito. L’imaging del tensore di diffusione del cervello intero può essere utilizzato per misurare i cambiamenti generali nella materia bianca ricca di mielina nel tempo – tali esperimenti negli esseri umani e nei roditori hanno dimostrato che l’apprendimento di un nuovo compito è correlato ad alterazioni della materia bianca nelle regioni cerebrali pertinenti (Scholz et al., 2009; Sampaio-Baptista et al., 2013). Analisi a livello cellulare in modelli animali dimostrano che la produzione di nuovi oligodendrociti mielinizzanti è necessaria per un apprendimento motorio efficiente (McKenzie et al., 2014; Xiao et al., 2016). Attualmente si ipotizza che l’attività del circuito neurale possa innescare cambiamenti nella mielina; un ampio corpo di ricerche ha dimostrato che l’attività neuronale può influenzare la proliferazione delle cellule precursori degli oligodendrociti (OPC), la differenziazione degli oligodendrociti e la formazione e la crescita delle guaine mieliniche. Questa ricerca, comprese le prove dei segnali molecolari coinvolti, è stata ampiamente rivista altrove (Fields, 2015; Almeida e Lyons, 2017; Mount e Monje, 2017). L’attività neuronale potrebbe guidare i cambiamenti alla mielina che potrebbe, a sua volta, cambiare le velocità di conduzione per mettere a punto le tempistiche alla base della funzione del circuito.
Tuttavia, non sappiamo ancora se o come la mielinizzazione dei circuiti sia regolata dinamicamente durante la vita. Il lavoro sui roditori indica che nuovi oligodendrociti sono generati in tutto il SNC anche in età adulta (Young et al., 2013), e le OPC risiedono nel cervello umano adulto (Chang et al., 2000). L’analisi di datazione al carbonio del tessuto umano ha identificato oligodendrociti nati da adulti all’interno della corteccia, anche se le stesse analisi hanno indicato che la maggior parte degli oligodendrociti nel corpo calloso hanno origine nella prima infanzia (Yeung et al., 2014). Tuttavia, gli studi di neuroimaging negli esseri umani che correlano le alterazioni strutturali della materia bianca con l’apprendimento dei compiti suggeriscono che la nuova mielina può essere formata per tutta la vita. Tale mielinizzazione prolungata richiederebbe in linea di principio la produzione di oligodendrociti per tutta la vita, dato che i singoli oligodendrociti mielinizzanti hanno una finestra temporale limitata di poche ore per iniziare la formazione di nuove guaine (Watkins et al., 2008; Czopka et al., 2013) e il numero di guaine per oligodendrocita sembra stabile nel tempo (Tripathi et al., 2017). Un avvertimento notato da Mount e Monje (2017) è che la data di “nascita” nell’esperimento di datazione al carbonio (che identifica il punto temporale della replicazione del DNA durante la divisione cellulare), riflette quella dell’OPC, non necessariamente l’oligodendrocita differenziato. Questo è importante data l’evidenza che le OPC possono differenziarsi direttamente in oligodendrociti senza divisione cellulare, almeno nei roditori (Hughes et al., 2013). Le OPC nel corpo calloso potrebbero differenziarsi direttamente in oligodendrociti molti anni dopo la loro divisione cellulare terminale; quindi il tempo di differenziazione di questi nuovi oligodendrociti non può essere determinato dalla datazione al carbonio, e quindi Yeung et al. (2014) potrebbero aver sottostimato il tasso di produzione di oligodendrociti nel cervello umano adulto. Abbiamo ancora molto da imparare sui contributi relativi della generazione di oligodendrociti e rimodellamento della mielina allo sviluppo del SNC per tutta la vita.
Per comprendere appieno le dinamiche precise di oligodendrogenesi, formazione e rimodellamento della mielina in varie fasi della vita, imaging longitudinale ad alta risoluzione rappresenta l’approccio gold-standard. Qui forniamo una panoramica dei recenti studi di imaging in vivo che stanno iniziando a chiarire le dinamiche della mielinizzazione, che ci permetteranno anche di iniziare a capire come tali dinamiche potrebbero avere un impatto sulla funzione dei circuiti neurali.
De novo Myelination
Per iniziare ad affrontare definitivamente come vengono generati gli oligodendrociti e come la mielina viene fatta e rimodellata dinamicamente in vivo, due studi recenti hanno utilizzato ripetute immagini a due fotoni della corteccia somatosensoriale del topo per lunghi periodi di tempo. Hughes et al. (2018) hanno fotografato la corteccia di topi transgenici reporter con cellule del lignaggio oligodendrogliale marcate con fluorescenza dalla prima età adulta, attraverso la mezza età e la vecchiaia (circa P720). Hanno trovato che la popolazione di oligodendrociti continua ad espandersi e che la densità corticale di oligodendrociti quasi raddoppia tra il giovane adulto e le fasi di mezza età (Figura 1A). Questo è stato accompagnato da un aumento di oltre due volte del numero di guaine mieliniche corticali. Ma come aumenta il numero di oligodendrociti? Nel primo sviluppo post-natale vengono prodotti molti oligodendrociti, ma solo un sottoinsieme sopravvive e va a mielinizzare gli assoni (Barres et al., 1992). Questo sembra essere simile in età adulta – seguendo singoli OPC corticali nella corteccia adulta per un massimo di 50 giorni, Hughes et al. (2018) hanno rivelato che la maggior parte degli oligodendrociti appena differenziati subiscono la morte cellulare, con solo il 22% che sopravvive e si impegna a mielinizzare (Figura 1B). Rimane sconosciuto quale proporzione di oligodendrociti appena differenziati sono generati dopo la divisione OPC rispetto alla differenziazione diretta. Tuttavia, una volta oligodendrociti impegnarsi a mielinizzazione rimangono stabili, senza alcuna prova di oligodendrociti mielinizzanti sottoposti a morte cellulare durante un periodo di 50 giorni di imaging.
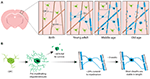
FIGURA 1. Dinamica degli oligodendrociti e della mielina nella corteccia dei mammiferi per tutta la vita. (A) Le cellule precursori degli oligodendrociti (OPC) generano continuamente nuovi oligodendrociti mielinizzanti (OL) nella corteccia somatosensoriale dalla nascita fino alla mezza età. La popolazione OL poi diminuisce in età avanzata, accompagnata da una riduzione della copertura mielinica. (B) Il lineage-tracing di singoli OPC mostra che, sebbene gli OL premielinizzanti siano continuamente prodotti in età adulta, solo il 20% circa sopravvive per mielinizzare. La maggior parte delle guaine mieliniche, una volta formate, sono stabili in lunghezza per un periodo di tempo prolungato, indicando che normalmente c’è pochissimo rimodellamento della mielina esistente. Riassunto dei dati di Hill et al. (2018) e Hughes et al. (2018).
Similmente, Hill et al. (2018) hanno usato reporter transgenici di oligodendrociti e la tecnica di microscopia di riflettanza spettrale confocale senza etichetta (SCoRe) per visualizzare la mielina lungo gli assoni (Schain et al., 2014) nella corteccia somatosensoriale di topi giovani, giovani adulti, di mezza età e vecchi (P950). Hanno anche scoperto che il numero di oligodendrociti continua ad espandersi in età adulta fino a P650, e che gli oligodendrociti sono stabili nella mezza età fino a 80 giorni di imaging. Hanno trovato che la mielinizzazione della corteccia ha anche un picco nella mezza età a P650, e che la densità degli oligodendrociti cade significativamente dal suo picco (a P650) attraverso la vecchiaia (P950) (Figura 1A). Ciò si riflette in una riduzione della copertura mielinica degli assoni corticali dello strato I tra P650 e P950. La sopravvivenza a lungo termine degli oligodendrociti può variare tra le diverse parti del SNC. Tripathi et al. (2017) hanno etichettato gli oligodendrociti mielinizzanti a P60 nei topi e poi hanno contato quante cellule etichettate sono sopravvissute fino a P605 in diverse regioni del SNC. Hanno scoperto che nel midollo spinale e nella corteccia motoria, il 60-70% delle cellule etichettate a P60 sono sopravvissute, mentre nel corpo calloso, più del 90% delle cellule etichettate a P60 sono sopravvissute. La riduzione del numero di oligodendrociti e della mielinizzazione in alcune regioni del SNC con l’età solleva domande intriganti sul ruolo della perdita di mielina nel declino cognitivo associato all’età. L’analisi MRI mostra che la microstruttura della materia bianca è correlata all’intelligenza fluida (Ritchie et al., 2015), ma anche che questa microstruttura della materia bianca si deteriora con l’aumentare dell’età (Cox et al., 2016). La successiva perdita di mielina associata all’età potrebbe portare a una ridotta funzione cognitiva a causa della disregolazione dei circuiti mielinizzati.
La generazione di nuovi oligodendrociti (e successivamente di nuova mielina) nella corteccia adulta potrebbe essere sensibile all’attività dei circuiti? Una ricerca precedente ha dimostrato che la riduzione dell’input sensoriale mediante la rimozione dei baffi dai topi porta a una ridotta oligodendrogenesi nella corteccia somatosensoriale (Hill et al., 2014). Per indagare ulteriormente questo, Hughes et al. (2018) hanno fornito ai topi adulti (P365) una stimolazione sensoriale per 3 settimane appendendo perline nelle gabbie degli animali per stimolare ripetutamente i loro baffi e quindi la corteccia somatosensoriale. Con l’imaging della corteccia somatosensoriale prima e dopo le 3 settimane, hanno dimostrato che la stimolazione sensoriale aumenta il numero di oligodendrociti, potenzialmente a causa della maggiore sopravvivenza delle cellule appena differenziate. Kougioumtzidou et al. (2017) hanno fornito ulteriori prove che l’attività del circuito può essere importante nella regolazione della sopravvivenza delle cellule – hanno dimostrato che la perdita delle subunità dei recettori AMPA 2, 3 e 4 nelle OPC porta a una ridotta sopravvivenza degli oligodendrociti. Questo suggerisce che la mielinizzazione de novo potrebbe essere modulata dall’attività del circuito corticale per tutta la vita, forse per mettere a punto la funzione di quegli stessi circuiti.
Molte domande rimangono da affrontare: qual è l’effetto dell’oligodendrogenesi e della nuova mielinizzazione sulla funzione effettiva del circuito? L’attività neuronale migliora la sopravvivenza a lungo termine degli oligodendrociti mielinizzati? È possibile che la perdita di oligodendrociti in età avanzata sia dovuta alla riduzione dell’attività neuronale associata all’età, che potrebbe, a sua volta, influenzare la sopravvivenza complessiva degli oligodendrociti. In alternativa, può essere che gli oligodendrociti abbiano una durata di vita limitata indipendente dall’attività neuronale (sia intrinsecamente programmata o influenzata da altri segnali estrinseci associati all’invecchiamento). In entrambi i casi, la stimolazione del circuito potrebbe aiutare ad alleviare la perdita di mielina associata all’età promuovendo la sopravvivenza degli oligodendrociti esistenti o stimolando la produzione di nuovi oligodendrociti. Questo a sua volta potrebbe avere implicazioni significative nel trattamento e nella prevenzione del declino cognitivo associato all’età.
L’oligodendrogenesi mediata dall’attività non è limitata alla corteccia somatosensoriale – giovani topi adulti sottoposti ad apprendimento motorio mostrano anche un aumento del numero di oligodendrociti appena differenziati nella corteccia motoria (Xiao et al., 2016). E le altre aree del sistema nervoso centrale? Molti assoni corticali proiettano attraverso il corpo calloso, e quindi, la stimolazione dei circuiti corticali potrebbe segnalare sia le OPC corticali che quelle callose. Due studi sui roditori hanno dimostrato che la stimolazione dei neuroni corticali induce l’oligodendrogenesi nel corpo calloso. Gibson et al. (2014) stimolato optogeneticamente strato V neuroni di proiezione nella corteccia premotoria, trovando un aumento della proliferazione OPC sia nella corteccia premotoria e corpo calloso. Questo ha portato ad un aumento del numero di oligodendrociti e dello spessore della guaina 4 settimane dopo la stimolazione. Più recentemente, Mitew et al. (2018) hanno usato Recettori esclusivamente attivati da Designer Drugs per stimolare i neuroni somatosensoriali dello strato 2/3, e hanno anche osservato un aumento della proliferazione OPC, oligodendrogenesi e guaine mieliniche più spesse nel corpo calloso sia in topi giovani che adulti. Hanno anche dimostrato che i nuovi oligodendrociti formano preferenzialmente guaine mieliniche sugli assoni attivi. Questo indica che la mielinizzazione de novo indotta dall’attività può, in linea di principio, mirare agli assoni/circuiti attivi. Rimane sconosciuto quanto possano essere durature le modifiche alla mielina in risposta all’attività neuronale. La sopravvivenza a lungo termine delle cellule mielinizzanti notata da Tripathi et al. (2017), Hill et al. (2018) e Hughes et al. (2018) suggerisce che una volta che un oligodendrocita forma le guaine mieliniche è probabile che sopravviva anche se i livelli di attività neuronale tornano al livello di base. Se le guaine mieliniche stesse cambiano una volta che l’attività neuronale torna a livelli normali richiede maggiori indagini sulle dinamiche delle singole guaine, che sono discusse di seguito.
Quindi, è possibile che la mielinizzazione de novo per tutta la vita possa avvenire in molte regioni del SNC, dove gli assoni adatti alla mielinizzazione hanno sufficiente spazio non mielinizzato. Tuttavia, rimane poco chiaro in che misura l’oligodendrogenesi continua in diverse aree del cervello umano adulto. L’analisi della datazione al carbonio suggerisce che la maggior parte degli oligodendrociti nel tratto del corpo calloso sono generati nella prima infanzia (Yeung et al., 2014). L’analisi immunoistochimica del tessuto cerebrale umano utilizzando un nuovo marcatore per gli oligodendrociti appena differenziati (BCAS1) mostra nuovi oligodendrociti nella corteccia frontale anche oltre la mezza età, ma pochissimi nuovi oligodendrociti nella materia bianca dopo la terza decade di vita (Fard et al., 2017). Questa differenza nell’oligodendrogenesi tra le specie potrebbe essere un risultato di scala. I dati di Hughes et al. (2013) sui roditori suggeriscono che gli oligodendrociti sono generati in enorme eccesso, con una continua potatura di quasi l’80% delle cellule. Dato il costo energetico di un tale processo, questo meccanismo è sostenibile per tutta la vita in un organo delle dimensioni del cervello umano? Forse nel cervello umano c’è una limitata sovrapproduzione di oligodendrociti, a causa della necessità di una mielinizzazione più prolungata del più grande SNC, o perché segnali come l’attività neuronale stimolano le OPC a differenziarsi in oligodendrociti come e quando richiesto.
Rimodellamento della mielina
Il rimodellamento delle guaine mieliniche esistenti potrebbe modificare le proprietà di conduzione senza la necessità di generare nuovi oligodendrociti o mielina. La modifica della lunghezza delle guaine mieliniche esistenti potrebbe cambiare la copertura mielinica lungo un assone e la distanza tra i nodi di Ranvier (che avrebbero entrambi un impatto sulla velocità di conduzione). Inoltre, anche un rimodellamento molto sottile della mielina potrebbe alterare la lunghezza dei nodi stessi. È stato recentemente dimostrato che la lunghezza dei nodi può variare ampiamente nel nervo ottico e nella corteccia, e che cambiare la lunghezza dei nodi lungo un assone può, in linea di principio, anche alterare significativamente la velocità di conduzione (Arancibia-Cárcamo et al., 2017). Se i cambiamenti del nodo di Ranvier sono principalmente guidati dalla mielinizzazione o dalla riorganizzazione dell’assone stesso rimane da determinare.
Sia Hill et al. (2018) che Hughes et al. (2018) hanno eseguito uno studio longitudinale delle singole guaine mieliniche nella corteccia somatosensoriale del topo per diverse settimane per valutare se le lunghezze delle guaine sono regolate dinamicamente. Hill et al. (2018) hanno scoperto che, nella prima età adulta (P90-120), anche se alcune guaine mostrano estensione o contrazione, l’81% delle guaine osservate erano stabili. Più guaine possono diventare stabili in lunghezza con l’età; Hughes et al. (2018) hanno seguito le guaine in animali più anziani (P365) e hanno visto che il 99% delle guaine è rimasto stabile su 3 settimane (Figura 1B).
Simile stabilità della lunghezza della guaina è stata descritta anche altrove; Auer et al. (2018) hanno usato zebrafish larvale per indagare se le singole guaine possono cambiare in lunghezza nel tempo eseguendo l’imaging live time-course delle guaine mieliniche etichettate in modo fluorescente. Hanno scoperto che le singole guaine subiscono una crescita rapida ma variabile nei primi giorni dopo la formazione, prima di stabilizzare le loro lunghezze di guaina. Una volta stabilizzate, le guaine continuano a crescere solo per adattarsi alla crescita complessiva dell’animale.
Perché alcune guaine nella corteccia cambiano in lunghezza, mentre altre no? Questo può riflettere la diversità nelle richieste di circuiti neurali distinti. La diversità assonale è stata osservata durante la mielinizzazione iniziale nel midollo spinale di zebrafish, dove alcuni assoni usano il rilascio di vescicole sinaptiche per regolare il numero e la lunghezza della guaina mielinica mentre altri non lo fanno (Koudelka et al., 2016). Questo solleva l’intrigante ipotesi che solo alcuni assoni sono in grado di regolare la mielina attraverso segnali legati all’attività. Hughes et al. (2018) hanno scoperto che il loro paradigma di stimolazione sensoriale non ha aumentato la proporzione di guaine dinamiche nella corteccia somatosensoriale. Tuttavia, un’analisi più dettagliata della diversità del sottotipo di assone accoppiata allo studio longitudinale della dinamica della lunghezza della guaina potrebbe confermare se il rimodellamento della lunghezza della guaina è specifico per alcuni circuiti.
La stabilità della lunghezza della guaina riflette un’incapacità delle guaine di rimodellare? Gli esperimenti nello zebrafish suggeriscono che il rimodellamento della lunghezza della guaina può essere indotto quando il profilo di mielinizzazione di un assone è interrotto. Auer et al. (2018) hanno ablato singoli oligodendrociti e quindi hanno rimosso le guaine lungo gli assoni. Hanno scoperto che quando una singola guaina mielinica viene persa su un assone completamente mielinizzato, le guaine vicine potrebbero reiniziare una rapida crescita per coprire il gap non mielinizzato. In diversi casi, una nuova guaina mielinica si forma al posto della precedente e potrebbe anche spingere indietro contro le guaine vicine invadenti per ripristinare il modello originale di mielinizzazione (Figura 2A). Pertanto, a volte un modello specifico di mielinizzazione è preferenzialmente mantenuto, anche dopo la rottura della mielina. Questo può essere per sostenere le proprietà di conduzione ottimizzate dell’assone sottostante. Auer et al. (2018) hanno osservato assoni scarsamente mielinizzati nel pesce zebra larvale, come precedentemente identificato nella corteccia dei roditori. È interessante notare che su ablazione di guaine singole su tali assoni scarsamente mielinizzati una nuova guaina formata praticamente nello stesso posto come la guaina ablata, anche lungo un tratto altrimenti non mielinizzato dell’assone (Figura 2B). Così i modelli di mielinizzazione lungo gli assoni scarsamente mielinizzati anche sembrano essere mantenuti stabilmente in zebrafish, come suggerito da Hill et al. (2018) nei roditori. La funzione dei profili di mielinizzazione sparsi rimane sconosciuta. Tali modelli possono consentire una messa a punto più dinamica della funzione del singolo assone nel tempo, anche se è anche possibile che tali lacune non mielinizzate possano facilitare la mielinizzazione graduale per mantenere tempi di conduzione coerenti all’interno dei circuiti, mentre l’animale cresce e/o la lunghezza degli assoni cambia.
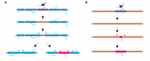
FIGURA 2. Il rimodellamento della mielina può avvenire in vivo. (A) L’ablazione di singole guaine su un assone completamente mielinizzato può indurre la rapida crescita di guaine vicine per coprire la lacuna. Questa lacuna può essere coperta interamente dalle guaine vicine, oppure il profilo originale di mielinizzazione può essere ripristinato dall’aggiunta di una nuova guaina. (B) L’ablazione di una guaina su un assone scarsamente mielinizzato è seguita dalla formazione di una nuova guaina mielinica di dimensioni e posizione identiche alla guaina ablata del predecessore. Riassunto dei dati di Auer et al. (2018).
Le guaine mieliniche stabili nei mammiferi hanno anche questa capacità di rimodellare quando il modello di mielinizzazione è interrotto? Ulteriori studi longitudinali accoppiati alla demielinizzazione sono necessari per rispondere a questa domanda. È possibile che tale rimodellamento non sia indotto dall’attività neuronale ma sia un meccanismo di compensazione per la perdita di mielina. La perdita di oligodendrociti associata all’età potrebbe innescare il rimodellamento delle guaine superstiti per coprire le porzioni di assone denudate e quindi aiutare a mantenere la funzione del circuito. L’imaging dal vivo delle guaine mieliniche in età avanzata potrebbe determinare se questo è il caso.
Gli studi di imaging dal vivo qui discussi hanno tutti valutato la dinamica della lunghezza della guaina mielinica, ma non il suo spessore. Lo spessore della guaina può essere regolato dinamicamente? La stimolazione della segnalazione PI3K/AKT/mTOR negli oligodendrociti di topi adulti innesca un ulteriore avvolgimento della mielina per aumentare lo spessore della guaina (Snaidero et al., 2014). Questo può essere modulato dall’attività del circuito, poiché la stimolazione neuronale porta ad un aumento dello spessore della guaina sia nei topi giovani che in quelli adulti (Gibson et al., 2014; Mitew et al., 2018). Questo evidenzia la necessità di immagine tutti i parametri guaina longitudinalmente per comprendere appieno le dinamiche di rimodellamento guaina. C’è bisogno di modalità di live-imaging per misurare accuratamente lo spessore della guaina lungo gli assoni, come attualmente questo richiede la misurazione trasversale tramite microscopia elettronica, che limita l’analisi ad un singolo punto temporale. Alcune tecniche di imaging senza etichetta, come la microscopia di generazione di terza armonica e riflettometria spettrale, mostrano la promessa per eseguire tali misure (Lim et al., 2014; Kwon et al., 2017). L’accoppiamento di queste tecniche con studi longitudinali della corteccia dei roditori potrebbe determinare se le guaine mieliniche stabilite possono regolare il loro spessore, o se l’attività neuronale spinge semplicemente la mielinizzazione de novo a produrre guaine più spesse.
Sembra quindi che, sebbene le guaine mieliniche siano in grado di rimodellare quando la mielina è interrotta, la maggior parte delle guaine sono generalmente stabili in lunghezza. Questa stabilità è potenzialmente dovuta al mantenimento di modelli di mielinizzazione precocemente stabiliti e ottimizzati per la funzione del circuito.
Il futuro
Recenti studi di imaging nei mammiferi si sono concentrati sulla mielinizzazione de novo e sul rimodellamento delle guaine nella materia grigia corticale. I circuiti corticali ricevono e inviano informazioni attraverso molte regioni, come il midollo spinale e il corpo calloso, e quindi i cambiamenti della mielina in diverse aree del SNC potrebbero alterare la segnalazione in un singolo circuito. Il sistema nervoso centrale è tradizionalmente descritto dall’aspetto dopo la fissazione in formaldeide, dove la “materia bianca” descrive i tratti assonali fortemente mielinizzati, mentre la “materia grigia” descrive le regioni densamente popolate di corpi cellulari neuronali, dendriti e sinapsi. Tuttavia, questa classificazione è eccessivamente semplicistica; le OPC producono oligodendrociti mielinizzanti sia nella materia grigia che in quella bianca (Dawson et al., 2003), e in effetti ci sono prove emergenti di diversità nel lineage oligodendrogliale e nei modelli di mielinizzazione sia nella materia grigia che in quella bianca (Rivers et al., 2008; Viganò et al., 2013; Young et al., 2013; Bechler et al., 2015). Tale diversità può riflettere i requisiti unici di mielina in aree distinte, e potenzialmente su circuiti distinti, del SNC. Ulteriori studi di imaging longitudinale sono necessari per comprendere meglio le dinamiche di de novo mielinizzazione e rimodellamento guaina in aree del SNC oltre la corteccia.
Mentre la trasparenza ottica del pesce zebra larvale si presta a non invasivo live imaging, eseguendo tali esperimenti nel SNC dei mammiferi è più invasivo e tecnicamente impegnativo. Hill et al. (2018) e Hughes et al. (2018) utilizzato microscopia a due fotoni con finestre di imaging craniale per profondità di immagine fino a 400 μm nella corteccia. Tecniche simili potrebbero essere utilizzate per l’immagine di tratti mielinizzati superficiali nel midollo spinale nel tempo (Locatelli et al., 2018), ma le regioni più profonde del SNC non possono essere penetrate dalla sola microscopia a due fotoni. Un’alternativa è quella di utilizzare la microendoscopia a due fotoni, dove una sonda microendoscopica con una lente a indice di rifrazione gradiente (GRIN) viene inserita nel tessuto per immagini di cellule più profonde nel cervello . Tuttavia, l’inserimento dell’endoscopio può portare a risposte infiammatorie che potrebbero avere un impatto sulla mielinizzazione. Un’alternativa potrebbe essere la microscopia a tre fotoni utilizzando il metodo della finestra di imaging craniale, che è stato anche precedentemente utilizzato per l’immagine dell’ippocampo (Horton et al., 2013; Ouzounov et al., 2017). Microscopia a tre fotoni dà un rapporto segnale-sfondo significativamente maggiore rispetto alla microscopia a due fotoni e può quindi essere utilizzato per immagini più profondo tessuto strutture.
È particolarmente importante considerare non solo diverse regioni del SNC, ma diversi neuroni all’interno di queste regioni. Ricerche precedenti suggeriscono che ci sono differenze meccanicistiche nel modo in cui distinti sottotipi di neuroni regolano la loro mielinizzazione (Koudelka et al., 2016). Inoltre, ci può essere diversità nella regolazione locale della mielina. È essenziale ricordare che le diverse parti del SNC non sono entità separate ma sono interconnesse. L’integrazione della connettomica su mesoscala, che si concentra sulla comprensione delle connessioni di diversi sottotipi di neuroni attraverso diverse regioni (Zeng, 2018), sarà fondamentale per la nostra comprensione di come le dinamiche di mielinizzazione a vita variano tra diversi circuiti.
Qual è la conseguenza funzionale della regolazione della mielina lungo circuiti distinti? Finora, le implicazioni funzionali possono essere dedotte solo da correlazioni con il comportamento. In definitiva, c’è la necessità di accoppiare la misurazione della dinamica della mielina con la valutazione diretta dell’attività del circuito. Ciò richiederà la registrazione dell’attività neuronale durante gli studi longitudinali di mielinizzazione per collegare direttamente la mielinizzazione de novo o il rimodellamento della guaina osservato ai cambiamenti nella funzione del circuito nel tempo. Sarà importante misurare la dinamica della mielina e l’attività elettrofisiologica dei singoli neuroni e degli assoni per determinare come i cambiamenti nei vari parametri della guaina mielinica influenzino effettivamente le proprietà di conduzione a livello di singola cellula, oltre a valutare l’attività a livello di popolazione. Strumenti come Ca2+ o indicatori di tensione codificati geneticamente permettono una registrazione relativamente non invasiva dell’attività del circuito, e possono anche essere utilizzati per valutare l’attività del circuito cerebrale intero (Ahrens et al., 2012; Lovett-Barron et al., 2017).
Conclusione
La mielinizzazione degli assoni rappresenta un potente meccanismo potenziale per regolare la funzione del circuito durante la vita. La ricerca ha dimostrato che la mielinizzazione de novo nella corteccia (attraverso la produzione di nuovi oligodendrociti) avviene anche in età adulta, e che questa può essere potenziata stimolando l’attività del circuito. Una volta che la mielina si è formata, è stabile con poco turnover di oligodendrociti e limitato rimodellamento delle lunghezze delle guaine mieliniche esistenti. Tuttavia, queste strutture stabili possono mantenere la capacità di rimodellare se la mielina viene disturbata. Questo ha interessanti implicazioni riguardo alla plasticità della mielina nel mantenere la funzione del circuito durante le lesioni, la malattia e la vecchiaia. Resta da vedere esattamente come i cambiamenti nella mielinizzazione influenzino la funzione del circuito sottostante. In definitiva, un approccio a livello di circuito, integrando l’analisi della dinamica della mielina con la misurazione diretta della funzione del circuito, è necessario per apprezzare pienamente come la mielinizzazione dinamica influenza la funzione complessiva del sistema nervoso per tutta la vita.
Contributi degli autori
Tutti gli autori elencati hanno dato un contributo sostanziale, diretto e intellettuale al lavoro e lo hanno approvato per la pubblicazione.
Finanziamento
DAL è sostenuto da un Wellcome Trust Senior Research Fellowship (102836/Z/13/Z). JMW è sostenuto da un University of Edinburgh Ph.D. Tissue Repair Studentship Award (MRC Doctoral Training Partnership MR/K501293/1) e dal Wellcome Trust Four-Year Ph.D. Program in Tissue Repair (Grant 108906/Z/15/Z).
Conflict of Interest Statement
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Ahrens, M. B., Li, J. M., Orger, M. B., Robson, D. N., Schier, A. F., Engert, F., et al. (2012). Brain-wide dinamiche neuronali durante l’adattamento motore in zebrafish. Natura 485, 471-477. doi: 10.1038/nature11057
PubMed Abstract | CrossRef Full Text | Google Scholar
Almeida, R. G., e Lyons, D. A. (2017). Sulla plasticità degli assoni mielinizzati e sulla formazione e funzione dei circuiti neuronali. J. Neurosci. 37, 10023-10034. doi: 10.1523/JNEUROSCI.3185-16.2017
CrossRef Full Text | Google Scholar
Arancibia-Cárcamo, I. L., Ford, M. C., Cossell, L., Ishida, K., Tohyama, K., e Attwell, D. (2017). Node of Ranvier length as a potential regulator of myelinated axon conduction speed. eLife 6:e23329. doi: 10.7554/eLife.23329
PubMed Abstract | CrossRef Full Text | Google Scholar
Auer, F., Vagionitis, S., and Czopka, T. (2018). Prove di rimodellamento della guaina mielinica nel SNC rivelato da imaging in vivo. Curr. Biol. 28, 549-559. doi: 10.1016/j.cub.2018.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Barres, B. A., Hart, I. K., Coles, H. S. R., Burne, J. F., Voyvodic, J. T., Richardson, W. D., et al. (1992). La morte cellulare e il controllo della sopravvivenza cellulare nel lignaggio oligodendrocyte. Cell 70, 31-46. doi: 10.1016/0092-8674(92)90531-G
CrossRef Full Text | Google Scholar
Bechler, M. E., Byrne, L., e Ffrench-Constant, C. (2015). CNS lunghezza della guaina mielinica sono una proprietà intrinseca di oligodendrociti. Curr. Biol. 25, 2411-2416. doi: 10.1016/j.cub.2015.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, A., Nishiyama, A., Peterson, J., Prineas, J., e Trapp, B. D. (2000). Cellule progenitrici oligodendrocitarie NG2-positive nel cervello umano adulto e nelle lesioni da sclerosi multipla. J. Neurosci. 20, 6404-6412. doi: 10.1523/JNEUROSCI.20-17-06404.2000
PubMed Abstract | CrossRef Full Text | Google Scholar
Cox, S. R., Ritchie, S. J., Tucker-Drob, E. M., Liewald, D. C., Hagenaars, S. P., Davies, G., et al. (2016). Invecchiamento e struttura della materia bianca del cervello in 3.513 partecipanti UK Biobank. Nat. Commun. 7:13629. doi: 10.1038/ncomms13629
PubMed Abstract | CrossRef Full Text | Google Scholar
Czopka, T., Ffrench-Constant, C., e Lyons, D. A. (2013). Singoli oligodendrociti hanno solo poche ore in cui generare nuove guaine di mielina in vivo. Dev. Cell 25, 599-609. doi: 10.1016/j.devcel.2013.05.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Dawson, M. R. L., Polito, A., Levine, J. M., e Reynolds, R. (2003). NG2-expressing cellule progenitrici gliali: una popolazione abbondante e diffusa di cellule di ciclismo nel CNS adulto del ratto. Mol. Cell. Neurosci. 24, 476-488. doi: 10.1016/S1044-7431(03)00210-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Fard, M. K., Van der Meer, F., Sánchez, P., Cantuti-Castelvetri, L., Mandad, S., Jäkel, S., et al. (2017). L’espressione BCAS1 definisce una popolazione di oligodendrociti mielinizzanti precoci nelle lesioni da sclerosi multipla. Sci. Transl. Med. 9:eaam7816. doi: 10.1126/scitranslmed.aam7816
PubMed Abstract | CrossRef Full Text | Google Scholar
Fields, R. D. (2015). Un nuovo meccanismo di plasticità del sistema nervoso: mielinizzazione dipendente dall’attività. Nat. Rev. Neurosci. 16, 756-767. doi: 10.1038/nrn4023
PubMed Abstract | CrossRef Full Text | Google Scholar
Ford, M. C., Alexandrova, O., Cossell, L., Stange-Marten, A., Sinclair, J., Kopp-Scheinpflug, C., et al. (2015). Tuning delle proprietà del nodo di Ranvier e internodo in assoni mielinizzati per regolare la tempistica del potenziale d’azione. Nat. Commun. 6:8073. doi: 10.1038/ncomms9073
PubMed Abstract | CrossRef Full Text | Google Scholar
Gibson, E. M., Purger, D., Mount, C. W., Goldstein, A. K., Lin, G. L., Wood, L. S., et al. (2014). Attività neuronale promuove oligodendrogenesi e mielinizzazione adattativa nel cervello dei mammiferi. Scienza 344:1252304. doi: 10.1126/science.1252304
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Li, A. M., e Grutzendler, J. (2018). Plasticità corticale della mielina per tutta la vita e degenerazione legata all’età nel cervello di mammifero vivo. Nat. Neurosci. 21, 683-695. doi: 10.1038/s41593-018-0120-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Patel, K. D., Goncalves, C. M., Grutzendler, J., e Nishiyama, A. (2014). Modulazione della generazione di oligodendrociti durante una finestra temporale critica dopo la divisione delle cellule NG2. Nat. Neurosci. 17, 1518-1527. doi: 10.1038/nn.3815
PubMed Abstract | CrossRef Full Text | Google Scholar
Horton, N. G., Wang, K., Kobat, D., Clark, C. G., Wise, F. W., Schaffer, C. B., et al. In vivo microscopia a tre fotoni di strutture sottocorticali all’interno di un cervello di topo intatto. Nat. Photonics 7, 205-209. doi: 10.1038/NPHOTON.2012.336
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, B., Wei, W., Wang, G., Gaertig, M. A., Feng, Y., Wang, W., et al. (2015). Mutante huntingtin downregulates myelin regulatory factor-mediata espressione del gene della mielina e colpisce oligodendrociti maturi. Neuron 85, 1212-1226. doi: 10.1016/j.neuron.2015.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Kang, S. H., Fukaya, M., e Bergles, D. E. (2013). Progenitori oligodendrociti equilibrio crescita con auto-repulsione per raggiungere l’omeostasi nel cervello adulto. Nat. Neurosci. 16, 668-676. doi: 10.1038/nn.3390
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., and Bergles, D. E. (2018). Rimodellamento della mielina attraverso l’oligodendrogenesi dipendente dall’esperienza nella corteccia somatosensoriale adulta. Nat. Neurosci. 21, 696-706. doi: 10.1038/s41593-018-0121-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Jung, J. C., Mehta, A. D., Aksay, E., Stepnoski, R., and Schnitzer, M. J. (2004). Imaging in vivo del cervello dei mammiferi utilizzando uno e due fotoni microendoscopia a fluorescenza. J. Neurophysiol. 92, 3121-3133. doi: 10.1152/jn.00234.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kang, S. H., Li, Y., Fukaya, M., Lorenzini, I., Cleveland, D. W., Ostrow, L. W., et al. (2013). Degenerazione e rigenerazione compromessa di oligodendrociti della materia grigia nella sclerosi laterale amiotrofica. Nat. Neurosci. 16, 571-579. doi: 10.1038/nn.3357
PubMed Abstract | CrossRef Full Text | Google Scholar
Koudelka, S., Voas, M. G., Almeida, R. G., Baraban, M., Soetaert, J., Meyer, M. P., et al. Singoli sottotipi neuronali mostrano diversità nella mielinizzazione del SNC mediata dal rilascio di vescicole sinaptiche. Curr. Biol. 26, 1447-1455. doi: 10.1016/j.cub.2016.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Kougioumtzidou, E., Shimizu, T., Hamilton, N. B., Tohyama, K., Sprengel, R., Monyer, H., et al. (2017). Segnalazione attraverso i recettori AMPA su precursori oligodendrociti promuove la mielinizzazione migliorando la sopravvivenza oligodendrociti. eLife 6: e28080. doi: 10.7554/eLife.28080
PubMed Abstract | Google Scholar | CrossRef Full Text
Kwon, J., Kim, M., Park, H., Kang, B.-M., Jo, Y., Kim, J.-H., et al. (2017). Label-free nanoscala metrologia ottica su assoni mielinizzati in vivo. Nat. Commun. 8:1832. doi: 10.1038/s41467-017-01979-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., e Webb, W. W. (2004). In vivo microscopia multifotone di tessuto cerebrale profondo. J. Neurophysiol. 91, 1908-1912. doi: 10.1152/jn.01007.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lim, H., Sharoukhov, D., Kassim, I., Zhang, Y., Salzer, J. L., e Melendez-Vasquez, C. V. (2014). Label-free imaging di mielinizzazione delle cellule di Schwann da microscopia terza generazione armonica. Proc. Natl. Acad. Sci. U.S.A. 111, 18025-18030. doi: 10.1073/pnas.1417820111
PubMed Abstract | CrossRef Full Text | Google Scholar
Locatelli, G., Theodorou, D., Kendirli, A., Jordão, M. J. C., Staszewski, O., Phulphagar, K., et al. (2018). Fagociti mononucleari localmente specificare e adattare il loro fenotipo in un modello di sclerosi multipla. Nat. Neurosci. 21, 1196-1208. doi: 10.1038/s41593-018-0212-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett-Barron, M., Andalman, A. S., Allen, W. E., Vesuna, S., Kauvar, I., Burns, V. M., et al. (2017). Circuiti ancestrali per la modulazione coordinata dello stato del cervello. Cell 171, 1411-1423. doi: 10.1016/j.cell.2017.10.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Mabbott, D. J., Noseworthy, M., Bouffet, E., Laughlin, S., e Rockel, C. (2006). Crescita della materia bianca come un meccanismo di sviluppo cognitivo nei bambini. Neuroimage 33, 936-946. doi: 10.1016/j.neuroimage.2006.07.024
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenzie, I. A., Ohayon, D., Li, H., Paes de Faria, J., Emery, B., Tohyama, K., et al. Apprendimento delle abilità motorie richiede attiva mielinizzazione centrale. Scienza 346, 318-322. doi: 10.1126/science.1254960
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitew, S., Gobius, I., Fenlon, L. R., McDougall, S. J., Hawkes, D., Xing, Y. L., et al. (2018). La stimolazione farmacogenetica dell’attività neuronale aumenta la mielinizzazione in un modo specifico dell’assone. Nat. Commun. 9:306. doi: 10.1038/s41467-017-02719-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mount, C. W., and Monje, M. (2017). Avvolto per adattarsi: mielinizzazione dipendente dall’esperienza. Neuron 95, 743-756. doi: 10.1016/j.neuron.2017.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Ouzounov, D. G., Wang, T., Wang, M., Feng, D. D., Horton, N. G., Cruz-Hernández, J. C., et al. (2017). Imaging in vivo a tre fotoni dell’attività dei neuroni marcati GCaMP6 in profondità nel cervello di topo intatto. Nat. Methods 14, 388-390. doi: 10.1038/nmeth.4183
PubMed Abstract | CrossRef Full Text | Google Scholar
Ritchie, S. J., Bastin, M. E., Tucker-Drob, E. M., Maniega, S. M., Engelhardt, L. E., Cox, S. R., et al. (2015). Cambiamenti accoppiati nella microstruttura della materia bianca del cervello e l’intelligenza fluida in età avanzata. J. Neurosci. 35, 8672-8682. doi: 10.1523/JNEUROSCI.0862-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Rivers, L. E., Young, K. M., Rizzi, M., Jamen, F., Psachoulia, K., Wade, A., et al. (2008). PDGFRA/NG2 glia generare oligodendrociti mielinizzanti e neuroni di proiezione piriforme nei topi adulti. Nat. Neurosci. 11, 1392-1401. doi: 10.1038/nn.2220
PubMed Abstract | CrossRef Full Text | Google Scholar
Sampaio-Baptista, C., Khrapitchev, A. A., Foxley, S., Schlagheck, T., Scholz, J., Jbabdi, S., et al. Apprendimento delle abilità motorie induce cambiamenti nella microstruttura della materia bianca e mielinizzazione. J. Neurosci. 33, 19499-19503. doi: 10.1523/jneurosci.3048-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Scantlebury, N., Cunningham, T., Dockstader, C., Laughlin, S., Gaetz, W., Rockel, C., et al. Relazioni tra maturazione della materia bianca e tempo di reazione nell’infanzia. J. Int. Neurophsychol. Soc. 20, 99-112. doi: 10.1017/S1355617713001148
PubMed Abstract | CrossRef Full Text | Google Scholar
Schain, A. J., Hill, R. A., e Grutzendler, J. (2014). Label-free imaging in vivo di assoni mielinizzati in salute e malattia con microscopia spettrale riflettanza confocale. Nat. Med. 20, 443-449. doi: 10.1038/nm.3495
PubMed Abstract | CrossRef Full Text | Google Scholar
Scholz, J., Klein, M. C., Behrens, T. E. J., e Johansen-berg, H. (2009). Formazione induce cambiamenti in bianco-materia architettura. Nat. Neurosci. 12, 1370-1371. doi: 10.1038/nn.2412
PubMed Abstract | CrossRef Full Text | Google Scholar
Snaidero, N., Möbius, W., Czopka, T., Hekking, L. H. P., Mathisen, C., Verkleij, D., et al. La membrana mielinica avvolgimento di assoni del SNC da PI (3,4,5)P3-dipendente crescita polarizzata alla lingua interna. Cell 156, 277-290. doi: 10.1016/j.cell.2013.11.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Takahashi, N., Sakurai, T., Davis, K. L., e Buxbaum, J. D. (2011). Collegare la disfunzione degli oligodendrociti e della mielina alle anomalie del neurocircuito nella schizofrenia. Prog. Neurobiol. 93, 13-24. doi: 10.1016/j.pneurobio.2010.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tomassy, G. S., Berger, D. R., Chen, H.-H., Kasthuri, N., Hayworth, K. J., Vercelli, A., et al. Profili distinti di distribuzione della mielina lungo gli assoni singoli di neuroni piramidali nella neocorteccia. Scienza 344, 319-324. doi: 10.1126/science.1249766
PubMed Abstract | CrossRef Full Text | Google Scholar
Tripathi, R. B., Jackiewicz, M., Mckenzie, I. A., Kougioumtzidou, E., Grist, M., e Richardson, W. D. (2017). Notevole stabilità degli oligodendrociti mielinizzanti nei topi. Cell Rep. 21, 316-323. doi: 10.1016/j.celrep.2017.09.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Viganò, F., Möbius, W., Götz, M., and Dimou, L. (2013). Il trapianto rivela differenze regionali nella differenziazione degli oligodendrociti nel cervello adulto. Nat. Neurosci. 16, 1370-1372. doi: 10.1038/nn.3503
PubMed Abstract | CrossRef Full Text | Google Scholar
Watkins, T. A., Emery, B., Mulinyawe, S., e Barres, B. A. (2008). Fasi distinte di mielinizzazione regolata da gamma-secretasi e astrociti in un sistema di cocoltura del SNC rapidamente mielinizzante. Neuron 60, 555-569. doi: 10.1016/j.neuron.2008.09.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Waxman, S. G. (1980). Determinanti della velocità di conduzione in fibre nervose mielinizzate. Muscle Nerve 3, 141-150. doi: 10.1002/mus.880030207
PubMed Abstract | CrossRef Full Text | Google Scholar
Xiao, L., Ohayon, D., Mckenzie, I. A., Sinclair-Wilson, A., Wright, J. L., Fudge, A. D., et al. (2016). Produzione rapida di nuovi oligodendrociti è richiesto nelle prime fasi di apprendimento di abilità motorie. Nat. Neurosci. 19, 1210-1217. doi: 10.1038/nn.4351
PubMed Abstract | CrossRef Full Text | Google Scholar
Yeung, M. S. Y., Zdunek, S., Bergmann, O., Bernard, S., Salehpour, M., Alkass, K., et al. Dinamica della generazione di oligodendrociti e mielinizzazione nel cervello umano. Cell 159, 766-774. doi: 10.1016/j.cell.2014.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Young, K. M., Psachoulia, K., Tripathi, R. B., Dunn, S.-J., Cossell, L., Attwell, D., et al. (2013). Dinamiche oligodendrocyte nel SNC adulto sano: prove di rimodellamento della mielina. Neuron 77, 873-885. doi: 10.1016/j.neuron.2013.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, H. (2018). Connettomica su mesoscala. Curr. Opin. Neurobiol. 50, 154-162. doi: 10.1016/j.conb.2018.03.003
PubMed Abstract | CrossRef Full Text | Google Scholar