Ti sei mai chiesto perché i bastoncini luminosi (vedi Fig. 1) brillano dopo che li hai piegati? O perché quelle stelle di plastica continuano a brillare di notte dopo che le luci sono state spente? Forse no. Comunque, che tu ti sia posto queste domande o no, il seguente testo spero ti fornirà risposte e spiegazioni sui fenomeni dei braccialetti luminosi, delle meduse brillanti, della luce nera, e molti altri.

Figura 1. Bastoncini luminosi.
Luminescenza
In generale, il bagliore che si verifica in tutti i fenomeni citati è chiamato luminescenza. La luminescenza è l’energia rilasciata da una sostanza sotto forma di luce. Si possono distinguere diversi tipi di luminescenza:
- Un esempio è la chemiluminescenza. Durante alcune reazioni chimiche, l’energia viene rilasciata come luce. Questo accade dopo aver piegato un bastoncino luminoso. È anche la ragione del bagliore di animali come le meduse o alcuni microrganismi. In questo caso, si chiama bioluminescenza.
- Un altro tipo è la triboluminescenza. Si può osservare quando si apre una busta autoadesiva nella completa oscurità o quando si srotola del nastro adesivo in una stanza buia. Così facendo, l’energia meccanica viene immessa nel sistema e serve come attivatore del bagliore.
- Probabilmente il tipo più familiare di luminescenza è la fotoluminescenza. Qui, l’energia è fornita dalla radiazione elettromagnetica, per esempio attraverso la luce del sole o una lampada ultravioletta, come in alcune discoteche. Questo provoca fenomeni come il continuo bagliore delle stelle di plastica o l’estrema luminosità dei vestiti bianchi sotto la luce nera. Si può differenziare la fluorescenza e la fosforescenza, che saranno spiegate di seguito.
Cos’è uno stato elettronicamente eccitato?
Generalmente, tutti i tipi di luminescenza sono basati sui cosiddetti processi fotofisici. Di solito, le molecole stesse sono descritte come fluorescenti. Questo è il caso dei coloranti fluorescenti come la fluoresceina o la curcumina. Tuttavia, per spiegare i processi fotofisici, bisogna guardare più da vicino ad un livello ancora più piccolo di quello molecolare.
Gli atomi dei diversi elementi hanno un numero diverso di elettroni distribuiti in diversi gusci e orbitali. Gli elettroni sono un tipo di particelle elementari. Le transizioni elettroniche sono responsabili della luminescenza. Quando il sistema assorbe energia, gli elettroni sono eccitati e vengono portati in uno stato energetico superiore. Prima dell’eccitazione, nello stato di terra, alcuni degli elettroni sono nel cosiddetto HOMO (Highest Occupied Molecular Orbital). Dopo aver raggiunto uno stato eccitato, sono nel LUMO (Lowest Unoccupied Molecular Orbital) (vedi Fig. 2). Come funziona esattamente questo verrà spiegato usando la fotoluminescenza come esempio specifico.

Figura 2. Eccitazione elettronica.
Diversi stati energetici di un atomo o di una molecola sono conosciuti come “livelli energetici”. A seconda della molecola e dell’atomo, gli elettroni possono occupare solo livelli energetici discreti poiché l’energia è quantizzata, il che significa che l’energia può essere assorbita ed emessa solo in certe quantità. La differenza tra due livelli può essere calcolata con l’equazione 1 (dove E2 è il livello di energia superiore ed E1 quello inferiore).
(1) ΔE = E2-E1
I fotoni, particelle di cui è composta la radiazione elettromagnetica o luce, devono avere un certo valore di energia per poter eccitare gli elettroni. L’energia di un fotone può essere calcolata con l’equazione 2, dove h è la costante di Planck e ν è la frequenza della luce.
(2) Ephoton = hν
L’energia di eccitazione necessaria agli elettroni è uguale alla differenza tra i livelli energetici. Solo la luce con una certa energia, e di conseguenza con una certa frequenza e lunghezza d’onda, è in grado di eccitare gli elettroni. Pareggiando le equazioni 1 e 2, e con l’aiuto dell’equazione 3 (dove c sta per la velocità della luce), la frequenza e la lunghezza d’onda necessarie possono essere calcolate (vedi eq. 4). In molti casi, la radiazione UV è usata per l’eccitazione.
(3) λ = c/ν
(4) ΔE = Ephoton ⇔ E2 – E1 = hν
ν = (E2 – E1)/h
λ = hc/(E2 – E1)
Disattivazione degli stati elettronicamente eccitati
Tali stati elettronicamente eccitati sono instabili. Gli elettroni ricadono nei loro stati di terra. Allo stesso tempo, l’energia di eccitazione viene rilasciata di nuovo. Si distingue tra processi di decadimento radiativo e non radiativo. La maggior parte delle volte, il decadimento è non radiativo, per esempio attraverso il rilassamento vibrazionale, il quenching con le molecole circostanti, o la conversione interna (IC). Questi processi saranno spiegati in dettaglio più avanti.
A volte, un decadimento radiativo può avvenire sotto forma di fluorescenza e fosforescenza. L’energia viene emessa come radiazione elettromagnetica o fotoni. La luce emessa ha una lunghezza d’onda più lunga e un’energia più bassa della luce assorbita perché una parte dell’energia è già stata rilasciata in un processo di decadimento non radiativo. Questa è la ragione per cui un’emissione nello spettro visibile può essere ottenuta mediante eccitazione con una radiazione UV non visibile. Questo spostamento verso una lunghezza d’onda più lunga è chiamato spostamento di Stokes .
Confronto: Fluorescenza vs. Fosforescenza
Sia la fluorescenza che la fosforescenza sono emissioni spontanee di radiazione elettromagnetica. La differenza è che il bagliore della fluorescenza cessa subito dopo lo spegnimento della fonte di radiazione eccitatoria, mentre per la fosforescenza, può verificarsi un postluminescenza con durata di frazioni di secondo fino a ore.
Per confrontare i processi fotofisici dietro entrambi i fenomeni, ci sono alcuni fatti sugli elettroni che sono utili per capire: Gli elettroni sono particelle che hanno un cosiddetto spin e un numero quantico di spin. Questo può avere due valori diversi, cioè +1/2 o -1/2 . Questo numero è una proprietà che in realtà non possiamo immaginare o descrivere facilmente. Viene spesso paragonato a una trottola che gira in senso orario o antiorario. Tuttavia, questa descrizione non è né matematicamente né fisicamente corretta. Due elettroni in un singolo orbitale di un atomo hanno spin antiparallelo, che si nota come (↓).
Fluorescenza
Nel diagramma di Jablonski per la fluorescenza (vedi Fig. 3), lo stato di spin singoletto S0 è lo stato fondamentale degli elettroni, e S1 e S2 sono stati eccitati singoletto (gli stati sono usati solo come esempio in questo testo e non si applicano necessariamente a certi atomi, molecole, ecc.) All’interno di questi stati, ci sono diversi livelli di energia. Più alto è il livello, più energia possiede un elettrone quando si trova in quel livello. Nel caso degli stati di singoletto, gli elettroni hanno rotazioni antiparallele.

Figura 3. Diagramma di Jablonski per la fluorescenza.
Gli elettroni sono sollevati dallo stato base S0, per esempio, a un livello energetico del secondo stato eccitato S2, quando sono eccitati dalla radiazione elettromagnetica. Dopo l’arresto dell’eccitazione, gli elettroni rimangono in quello stato eccitato solo per un breve periodo di tempo (circa 10-15 s) e poi iniziano immediatamente a ricadere nello stato fondamentale. Così facendo, l’energia inizialmente può essere rilasciata all’ambiente circostante attraverso il rilassamento vibrazionale. Ciò significa che l’energia termica viene rilasciata dal movimento dell’atomo o della molecola fino al raggiungimento del livello più basso del secondo stato eccitato.
Il divario maggiore tra il secondo e il primo stato eccitato viene superato dalla conversione interna. Questo descrive una transizione elettronica tra due stati mentre lo spin degli elettroni è mantenuto. Ora, gli elettroni possono rilassarsi ulteriormente a causa di un maggiore rilassamento vibrazionale fino a raggiungere il livello energetico più basso dello stato S1.
Teoricamente, gli elettroni potrebbero rilassarsi ancora di più in modo non radiativo fino a raggiungere nuovamente lo stato fondamentale. Tuttavia, può accadere che l’ultima quantità di energia sia troppo grande per essere rilasciata nell’ambiente circostante perché le molecole circostanti non possono assorbire tanta energia. Allora si verifica la fluorescenza, che porta all’emissione di fotoni con una certa lunghezza d’onda. L’emissione dura solo fino a quando gli elettroni non tornano nello stato di terra. Poiché durante tutte queste transizioni lo spin dell’elettrone è mantenuto lo stesso, esse sono descritte come spin-allowed.
Fosforescenza
Per la fosforescenza, le cose sono un po’ diverse (vedi Fig. 4). Ci sono di nuovo uno stato di terra S0 e i due stati eccitati, S1 e S2. Inoltre, c’è uno stato eccitato di tripletta T1 che si trova energeticamente tra lo stato S0 e S1. Gli elettroni hanno di nuovo spin antiparalleli nello stato di terra.
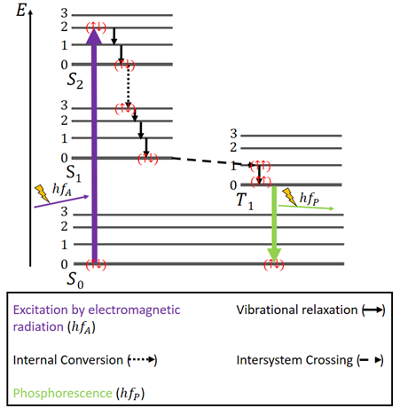
Figura 4. Diagramma di Jablonski per la fosforescenza.
L’eccitazione avviene nello stesso modo della fluorescenza, cioè attraverso la radiazione elettromagnetica. Il rilascio di energia attraverso il rilassamento vibrazionale e la conversione interna mantenendo lo stesso spin è lo stesso anche qui, ma solo fino al raggiungimento dello stato S1.
Oltre agli stati di singoletto, esiste uno stato di tripletto e il cosiddetto intersystem crossing (ISC) può avvenire poiché lo stato T1 è energeticamente più favorevole dello stato S1. Questo attraversamento, come la conversione interna, è una transizione elettronica tra due stati eccitati. Ma contrariamente alla conversione interna, ISC è associato a un’inversione di spin da singoletto a tripletto. Gli elettroni nello stato di tripletto hanno spin paralleli, che si nota come () . Questo processo ISC è descritto come “spin-forbidden”. Non è completamente impossibile – a causa di un fenomeno chiamato “accoppiamento spin-orbita” – tuttavia, è piuttosto improbabile.
Nello stato T1, è possibile anche il decadimento non radiativo. Tuttavia, una transizione tra il livello energetico più basso dello stato di tripletto e lo stato S0 non è facilmente possibile, perché anche questa transizione è proibita dallo spin. Tuttavia, può accadere comunque con una piccola possibilità. Causa un’emissione piuttosto debole di fotoni perché lo spin dell’elettrone deve essere invertito di nuovo. L’energia è intrappolata in questo stato per un po’ e può essere rilasciata solo lentamente. Dopo che tutta l’energia è stata rilasciata, gli elettroni sono di nuovo nello stato di terra.
Conclusione
I processi di spin consentito e vietato servono come spiegazione per un bagliore di fluorescenza che cessa immediatamente e per il bagliore di fosforescenza. La fosforescenza si verifica di solito solo con le molecole più “pesanti”, poiché lo spin deve essere invertito con l’aiuto di spin-orbit-coupling. Se la radiazione elettromagnetica viene emessa, e con quale lunghezza d’onda, dipende da quanta energia può essere rilasciata in anticipo dal decadimento non radiativo. Dipende anche dalle proprietà dei cosiddetti quenchers che sono molecole circostanti e sono in grado di assorbire maggiori quantità di energia.
Tutti i processi che possono portare ad una inibizione dei decadimenti radiativi possono causare il quenching della fluorescenza. Esempi sono i processi di decadimento non radiativo, ma anche la distruzione della molecola fluorescente. L’efficienza quantica descrive l’efficienza del processo ed è definita come il rapporto tra fotoni assorbiti ed emessi. Questa proprietà è diversa per ogni sostanza.
Anche se questo testo si concentra sulla fotoluminescenza, i processi fotofisici sono gli stessi per tutti i tipi di luminescenza.
Applicazioni
Oltre a prodotti come i bastoncini luminosi, la fluorescenza e la fosforescenza sono utilizzate in molti altri modi. Altri esempi sono i pali guida che conducono a un’uscita di emergenza che non hanno bisogno di alimentazione elettrica ma brillano di notte grazie alla fosforescenza. Anche le piante possono essere rese fluorescenti: Gli spinaci possono essere modificati con l’aiuto della nanotecnologia in modo che possano rilevare tracce di sostanze esplosive nelle acque sotterranee. Le foglie contengono nanotubi di carbonio a cui possono legarsi i nitroaromatici. Se lo fanno, un segnale fluorescente viene rilasciato dalla pianta e può essere rilevato con telecamere a infrarossi .
Il video dimostra diversi tipi di luminescenza. A sinistra, mostra la fluorescenza del colorante curcumina, che è contenuto nella spezia curcuma, sotto la luce UV. La curcumina è sciolta in alcool per rendere visibile la fluorescenza.
Il ragno di plastica e il composto nel tubetto sono esempi di fosforescenza. L’alluminato di stronzio, che è contenuto nel tubetto, è inizialmente eccitato dai raggi UV e alla fine emette luce verde. La causa di ciò è un drogaggio con elementi come l’Europio, che rende il composto utilizzabile come pigmento luminescente.
Flettere il bastoncino luminoso (a destra) avvia una reazione chimica tra il perossido di idrogeno e un colorante e l’ossalato di fenile. Si può osservare la chemiluminescenza.
Video 1. Fluorescenza, fosforescenza e chemiluminescenza a confronto.
K. Arnold et al., Chemie Oberstufe (in tedesco), Cornelsen Schulverlage, Berlino, 2015, 496-497. ISBN: 978-3-06-011179-4
Lexikon der Physik: Lumineszenz (in tedesco), spektrum.de. (accesso 25 gennaio 2017)
D. Wiechoczek, Wenn Mineralien selber leuchten – Phosphoreszenz, Fluoreszenz und Lumineszenz (in tedesco), chemieunterricht.de 2010. (accesso 25 gennaio 2017)
Lexikon der Physik: Photophysikalische Prozesse (in tedesco), spektrum.de. (accesso 27 gennaio 2017)
D. Wiechoczek, Chemie mit Curry (in tedesco), chemieunterricht.de 2015. (accesso 27 gennaio 2017)
P. W. Atkins, J. de Paula, Kurzlehrbuch Physikalische Chemie (in tedesco), Wiley-VCH, Weinheim, 2008, 853ss, 921ss. ISBN: 978-3-527-31807-0
P. W. Atkins, Physical Chemistry, Oxford University Press, 1994, 591ff.
Quantelung (in tedesco), chemie.de. (accesso 27 gennaio 2017)
Relazione di frequenza di Bohr (in tedesco), chemgapedia.de. (accessed January 25, 2017)
Università di tecnologia di Ilmenau, Corso pratico di chimica fisica II: chimica fisica/tecnologia di microreazione, esperimento di quenching di fluorescenza (in tedesco), tu-ilmenau.de. (accesso 27 gennaio 2017)
spostamento di Stokes (in tedesco), chemie.de. (accesso 25 gennaio 2017)
Spin degli elettroni (in tedesco), chemie.de. (accesso 27 gennaio 2017)
Rendimento quantico (in tedesco), chemie.de. (accesso 27 gennaio 2017)
Gli spinaci rilevano esplosivi nelle acque sotterranee (in tedesco), Spiegel Online, 1 novembre 2016. (accesso 27 gennaio 2017)
D. Weiß, Phosphorescence (in tedesco), chemie.uni-jena.de. (accesso 27 gennaio 2017)
 Kim Dreier è uno studente del Marianne-Weber-Gymnasium (scuola secondaria) di Lemgo, Germania.
Kim Dreier è uno studente del Marianne-Weber-Gymnasium (scuola secondaria) di Lemgo, Germania.