Aspartato aminotransferasi di Luke Spooner
Contenuti
- 1 Funzione
- 2 Struttura
- 3 Funzione
- 4 Applicazioni cliniche
- 5 Strutture 3D dell’aspartato aminotransferasi
Funzione
Aminotransferasi aspartato (AAT), conosciuta anche come transaminasi glutammica aspartica, transaminasi glutammica ossalacetica, prefenato aminotransferasi e transaminasi A è un enzima membro della famiglia delle aminotransferasi dipendenti dal piridossal-fosfato di classe I. È codificato dal gene GOT1. È un omodimero lungo 413 aminoacidi e svolge un ruolo critico nel metabolismo degli aminoacidi e dei carboidrati, nell’ureogenesi e nel trasferimento di equivalenti riducenti nei mitocondri e nel cloroplasto. Nelle cellule procariote si trova esclusivamente nel citosol, ma nelle cellule eucariotiche ci sono isozimi del citosol, del mitocondrio e del cloroplasto. L’aspartato aminotransferasi bifunzionale (BAAT) è necessaria per la transaminazione del prefanato in arogenato.
Nel corpo umano è prodotto nel cervello, nei muscoli scheletrici, nel fegato, nel pancreas, nei globuli rossi e nei reni. L’ampia gamma di tessuti in cui viene prodotta, la separa dal simile enzima alanina transaminasi (ALT) che si trova principalmente nel fegato. Il livello di AAT nel corpo può essere usato come marcatore di malattie o danni ai tessuti. Inoltre, i livelli di AAT e ALT possono essere confrontati per individuare se i danni ai tessuti si trovano principalmente nel fegato.
Struttura
che contiene (elici alfa, fili beta, anelli, giri). Unità asimmetrica di Aspartato aminotransferasi, con evidenziato il piccolo e grande dominio e il cofattore PLP (1b4x). Ogni subunità contiene un sito attivo equivalente. Le subunità si collegano in due siti: tra i loro grandi domini e tra i residui N-terminali e il grande dominio sull’altra subunità. Questa struttura dell’AST varia minuziosamente tra gli organismi, dall’E. coli all’uomo. Inoltre, la struttura del sito attivo è altamente conservata con un’omologia di sequenza del 25%.
Ogni subunità dell’omodimero è ulteriormente divisa in un piccolo e grande dominio. Il è composto dagli aminoacidi dal N-terminale al residuo Pro 48 e da Met 326 al C-terminale. I restanti aminoacidi costituiscono il , e sono collegati da una lunga α-elica composta da 32 aminoacidi.
Il grande dominio è dove si trova il sito attivo di AAT e per ospitare questo, il nucleo contiene molte strutture α/β supersecondarie. Questo è in contrasto con il nucleo della piccola subunità che è formato da due α-eliche e due β-fili. Negli organismi multicellulari c’è una piega al 325° residuo che agisce come una cerniera per il piccolo dominio, che permette i conseguenti cambiamenti conformazionali che avvengono al legame degli inibitori all’enzima.
Come detto sopra, il sito attivo di AST è situato sul grande dominio della subunità. All’interno del sito attivo si trova il residuo amminico Lys 258, noto anche come aldimina interna, che si lega con il cofattore Piridossal 5′-fosfato () formando quella che viene chiamata una base di Schiff. All’aggiunta di un substrato aminoacido, si forma una nuova base di Schiff tra PLP e l’aminoacido.
Funzione
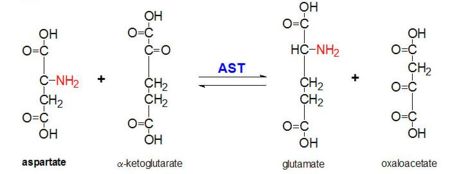
Figura 2: Reazione di transaminazione di L-aspartato e α-chetoglutarato catalizzata dall’aspartato aminotransferasi
AAT catalizza la transaminazione reversibile del gruppo α-ammino da L-aspartato a α-chetoglutarato formando ossalacetato e glutammato. Questa reattività è più bassa nell’E.coli che negli eucarioti superiori, e ha una più ampia specificità di substrato. Tuttavia, la reazione avviene nello stesso modo. All’introduzione di un substrato aminoacido, una nuova base di Schiff si forma tra esso e il cofattore PLP. Questo fa sì che l’amminoacido perda un idrogeno e formi un quinoide intermedio, e la riprotezione avviene dando luogo a una chetamina. Successivamente, la struttura viene idrolizzata formando un acido α-cheto e un fosfato di piridossamina. Il 2-metil aspartato agisce come inibitore dell’AAT quando forma una base Schiif con il cofattore PLP, piuttosto che l’aspartato. Questo provoca l’arresto del processo nella fase precedente all’eliminazione della proteina alfa.
Questa reazione è essenziale per mantenere l’omeostasi negli organismi. Le quattro diverse molecole che possono formarsi come risultato di questa transanimazione (ossalacetato, α-chetoglutarato, aspartato, L-glutammato) sono fondamentali per una serie di processi metabolici. L’ossalacetato e l’α-chetoglutarato svolgono un ruolo critico nel ciclo di Krebs, varie forme di aspartato sono molecole importanti nel ciclo dell’urea e partecipano alla gluconeogenesi, e il glutammato è una molecola importante nei percorsi metabolici associati alla memoria.
Applicazioni cliniche
I livelli di AAT nel corpo sono indicativi di danni e malattie dei tessuti. Normalmente l’AAT si trova in quantità minime nel sangue, tuttavia quando gli organi menzionati sopra sono danneggiati, l’AAT viene rilasciato nel sangue. La quantità rilasciata è proporzionale al livello di danno subito. È stato dimostrato che i livelli di AAT aumentano sostanzialmente entro 6 ore dalla degradazione iniziale del tessuto e possono rimanere elevati fino a 4 giorni. I livelli di AAT, se confrontati con i livelli di altri enzimi, possono essere utilizzati dai medici per determinare dove nel corpo ha avuto luogo il danno. Il confronto con l’ALT si è dimostrato particolarmente utile per identificare danni al fegato come la cirrosi e l’epatite. In condizioni normali, i livelli di AAT negli uomini sono 6-34 IU/L e per le donne sono 8-40 IU/L.
Strutture 3D di aspartato aminotransferasi
Strutture 3D di aspartato aminotransferasi