La sezione precedente mostra come diversi elementi possono esistere da soli o combinarsi con altri elementi per creare composti. Questa sezione si basa su queste idee guardando le reazioni chimiche in modo più dettagliato. Mostra anche come la stenografia chimica può essere estesa alla descrizione delle reazioni chimiche.
Primo, considera alcune delle molecole descritte prima: acqua, metano, anidride carbonica e ammoniaca.
Questione 26
Quali sono le formule per ciascuna di queste quattro molecole?
Risposta
Le formule sono rispettivamente H2O, CH4, CO2 e NH3.
Anche se non hai bisogno di ricordare le formule chimiche dei composti introdotti in questo corso, probabilmente troverai utile memorizzarne alcune come quelle per le quattro molecole sopra, più quelle per le molecole di idrogeno (H2), azoto (N2) e ossigeno (O2). Questo ti aiuterà a leggere e scrivere queste formule chimiche senza dover continuamente fare riferimento alle sezioni precedenti.
Ora guarderai le reazioni che coinvolgono gli elementi idrogeno, carbonio e ossigeno e i composti metano, acqua e anidride carbonica.
L’idrogeno reagirà con l’ossigeno quando viene acceso (è abbastanza esplosivo) per formare acqua. Per scrivere una tale reazione in termini di un’equazione chimica, le sostanze che subiscono la reazione sono messe a sinistra e le sostanze che sono prodotte nella reazione sono messe a destra. I reagenti sulla sinistra sono collegati ai prodotti sulla destra da una freccia.
L’equazione può essere scritta come un’equazione verbale ‘idrogeno e ossigeno fanno l’acqua’ o, usando un po’ di stenografia chimica, può essere scritta come:

dove la freccia significa ‘va a’.
Ora, prova ad usare la stenografia chimica per scrivere l’equazione. Sostituendo i simboli nella parola equazione si ottiene:

L’equazione mostra i reagenti a sinistra della freccia che vengono convertiti nel prodotto a destra. Tuttavia, c’è qualcosa di sbagliato in questa equazione. Puoi vedere cosa c’è di sbagliato guardando la figura 21 dove i reagenti e i prodotti sono mostrati come un diagramma.
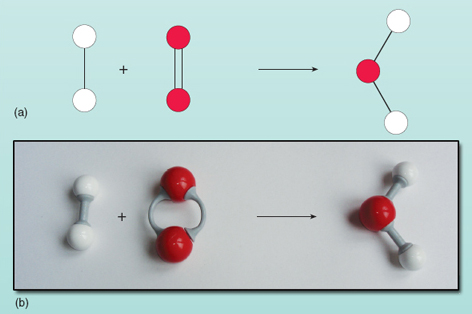
Contare il numero di atomi su ogni lato dell’equazione mostra che ci sono due atomi di ossigeno a sinistra rispetto a uno a destra. Il numero di atomi di ossigeno su entrambi i lati dell’equazione deve essere uguale – non possono magicamente apparire e scomparire durante una reazione. Non è possibile cambiare la composizione della molecola d’acqua sulla destra dell’equazione poiché la molecola d’acqua esiste come un gruppo di due atomi di idrogeno e un atomo di ossigeno tutti legati insieme. Ogni molecola di ossigeno fornisce due atomi di ossigeno e quindi formerà sempre due molecole d’acqua, a condizione che ci siano due molecole di idrogeno (ciascuna delle quali è un’unità di due atomi) per reagire con essa. Così, due molecole di idrogeno e una molecola di ossigeno sono necessarie per fare due molecole di acqua. La reazione è accuratamente espressa da:

Ora c’è lo stesso numero di ogni tipo di atomo su entrambi i lati dell’equazione: l’equazione chimica è bilanciata, quindi possiamo sostituire la freccia con un segno di uguale.
Un ultimo riordino per evitare di ripetere le molecole di idrogeno a sinistra dell’equazione e le molecole di acqua a destra è rappresentarle con 2H2 piuttosto che H2 + H2. Così l’equazione chimica bilanciata diventa:

Questo è mostrato diagrammaticamente nella figura 22.

Le equazioni chimiche mostrano in modo molto conciso non solo quali atomi e molecole reagiscono insieme per formare i prodotti ma anche quanti di ogni tipo di atomo e molecola sono coinvolti. È importante ricordare che il numero prima di una molecola significa il numero di quella particolare molecola. Per esempio 3H2O significa tre molecole di acqua, per un totale di sei atomi di idrogeno e tre di ossigeno.
Le equazioni chimiche devono bilanciarsi; il numero di atomi di ogni tipo di elemento su entrambi i lati dell’equazione deve essere uguale.
Ora sai come “leggere” o interpretare un’equazione chimica – e come essa rappresenta un processo chimico. Tuttavia, i chimici sono anche molto abili a scrivere equazioni chimiche come forma di stenografia per descrivere vari processi o reazioni chimiche. Scrivere equazioni chimiche è come scrivere in qualsiasi lingua straniera – richiede pratica per diventare fluente. Tuttavia, tutti gli scienziati in erba devono iniziare da qualche parte e la sezione qui sotto ti mostra come farlo usando una reazione chimica molto familiare. Se vuoi verificare se hai bisogno di studiare questa sezione, prova prima la domanda 20.
.