Definizione nelle reazioni chimiche
In questo capitolo, impareremo alcune reazioni in cui i passi chiave coinvolgono il movimento di singoli elettroni. Forse ricorderete, dalla sezione 6.1A, che il movimento di un singolo elettrone è rappresentato da una freccia a uncino (al contrario delle famose frecce a doppia barra che abbiamo usato per tutto il libro per mostrare il movimento di due elettroni).

I meccanismi a singolo elettrone coinvolgono la formazione e la successiva reazione di specie di radicali liberi, intermedi altamente instabili che contengono un elettrone spaiato. Impareremo in questo capitolo come i radicali liberi si formino spesso dalla scissione omolitica, un evento in cui i due elettroni in un legame covalente che si rompe si muovono in direzioni opposte.

(Al contrario, essenzialmente tutte le reazioni che abbiamo studiato fino ad ora coinvolgono eventi di rottura del legame in cui entrambi gli elettroni si muovono nella stessa direzione: questo è chiamato scissione eterolitica).
Impareremo anche che molti meccanismi a singolo elettrone prendono la forma di una reazione radicale a catena, in cui un radicale causa la formazione di un secondo radicale, che a sua volta causa la formazione di un terzo radicale, e così via.
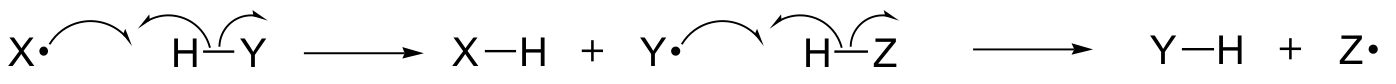
L’alta reattività delle specie radicali libere e la loro capacità di iniziare reazioni a catena è spesso vantaggiosa – impareremo in questo capitolo le reazioni di polimerizzazione radicale che formano materiali utili come il plexiglass e il tessuto di polipropilene. Impareremo anche le reazioni radicaliche che sono dannose, come la degradazione dell’ozono atmosferico da parte del freon, e il danno ossidativo fatto ai lipidi e al DNA nel nostro corpo dalle specie di radicali liberi. Infine, vedremo come alcuni enzimi usano metalli legati per catalizzare alte e
La geometria e la stabilità relativa dei radicali di carbonio
Come chimici organici, siamo particolarmente interessati agli intermedi radicali in cui l’elettrone spaiato risiede su un atomo di carbonio. L’evidenza sperimentale indica che i tre legami in un radicale di carbonio hanno una geometria trigonale planare, e quindi il carbonio è considerato come sp2-ibridizzato con l’elettrone spaiato che occupa il 2pzorbitale perpendicolare e non ibridizzato. Contrasta questo quadro con i carbocationi e i carbanioni intermedi, che sono entrambi anche trigonali planari ma i cui orbitali 2pz contengono zero o due elettroni, rispettivamente.

La tendenza nella stabilità dei radicali di carbonio è parallela a quella dei carbocationi (sezione 8.4B): i radicali terziari, per esempio, sono più stabili dei radicali secondari, seguiti dai radicali primari e metilici. Questo dovrebbe avere un senso intuitivo, perché i radicali, come i carbocationi, possono essere considerati carenti di elettroni, e quindi sono stabilizzati dagli effetti elettron-donanti dei gruppi alchilici vicini. I radicali benzilici e allilici sono più stabili dei radicali alchilici a causa degli effetti di risonanza – un elettrone spaiato può essere delocalizzato su un sistema di legami pi coniugati. Un radicale allilico, per esempio, può essere raffigurato come un sistema di tre orbitali 2pz paralleli che condividono tre elettroni.
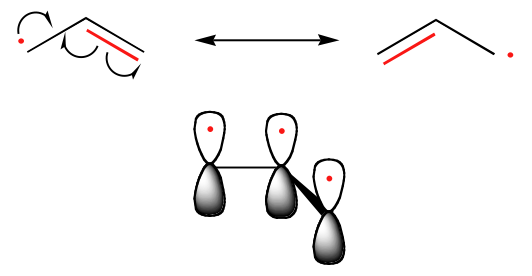
Tendenze nella stabilità dei radicali
Allicico & Benzilico > 3o > 2o > 1o > Metile

In questa molecola, la già estesa stabilizzazione della risonanza è ulteriormente migliorata dalla capacità degli atomi di cloro di proteggere il centro del radicale dai reagenti esterni. Il radicale è, in un certo senso, all’interno di una “gabbia” protettiva.
Organic Chemistry With a Biological Emphasis di Tim Soderberg (University of Minnesota, Morris)
-
Prof. Steven Farmer (Sonoma State University)
- Layne A. Morsch (University of Illinois Springfield)