Az előző részben bemutattuk, hogy a különböző elemek vagy önmagukban léteznek, vagy más elemekkel egyesülve vegyületeket alkotnak. Ez a szakasz ezekre az elképzelésekre építve részletesebben megvizsgálja a kémiai reakciókat. Azt is megmutatja, hogyan lehet a kémiai gyorsírást kiterjeszteni a kémiai reakciók leírására.
Először is nézzünk meg néhányat a korábban leírt molekulák közül: víz, metán, szén-dioxid és ammónia.
Kérdés 26
Milyen képletekkel rendelkezik mind a négy molekula?
Válasz
A képletek a következők: H2O, CH4, CO2 és NH3.
Noha nem kell megjegyezned a kurzus során bemutatott vegyületek kémiai képleteit, valószínűleg hasznos lesz néhányat megjegyezned, például a fenti négy molekula, valamint a hidrogén (H2), nitrogén (N2) és oxigén (O2) molekulák képleteit. Ez segíteni fog abban, hogy ezeket a kémiai képleteket el tudd olvasni és leírni anélkül, hogy folyamatosan visszautalnál az előző részekre.
Most a hidrogén, a szén és az oxigén elemeket, valamint a metán, a víz és a szén-dioxid vegyületeket érintő reakciókat fogod megvizsgálni.
A hidrogén gyújtáskor (elég robbanékony) oxigénnel reagálva vizet képez. Egy ilyen reakciót kémiai egyenlet formájában úgy írhatunk fel, hogy a reakcióban részt vevő anyagokat a bal oldalra, a reakcióban keletkező anyagokat pedig a jobb oldalra tesszük. A bal oldali reaktánsokat egy nyíl köti össze a jobb oldali termékekkel.
Az egyenletet felírhatjuk szóegyenletként “hidrogénből és oxigénből víz keletkezik”, vagy egy kis kémiai gyorsírással így is leírhatjuk:

ahol a nyíl azt jelenti, hogy “oda megy”.
Most próbáld meg a kémiai gyorsírást használni az egyenlet felírásához. A szimbólumok behelyettesítésével a szóegyenletben a következőket kapjuk:

Az egyenlet azt mutatja, hogy a nyíl bal oldalán lévő reaktánsok a jobb oldalon lévő termékké alakulnak át. Valami azonban nem stimmel ebben az egyenletben. Hogy mi a baj, azt a 21. ábrán láthatod, ahol a reaktánsok és a termékek ábrázolva vannak.
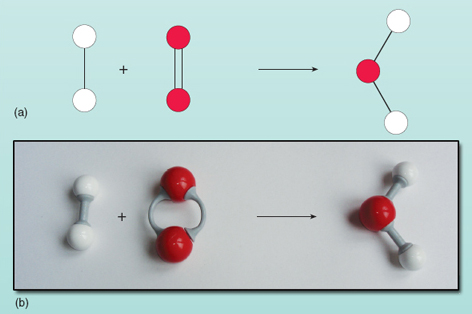
Az egyenlet mindkét oldalán lévő atomok számát megszámolva látható, hogy a bal oldalon két oxigénatom van, szemben a jobb oldalon lévő eggyel. Az egyenlet mindkét oldalán lévő oxigénatomok számának egyenlőnek kell lennie – nem jelenhetnek meg és tűnhetnek el varázslatos módon a reakció során. Az egyenlet jobb oldalán lévő vízmolekula összetételét nem lehet megváltoztatni, mivel a vízmolekula két hidrogénatomból és egy oxigénatomból álló, egymással összekapcsolt csoportként létezik. Minden oxigénmolekula két oxigénatomot szolgáltat, így mindig két vízmolekulát képez, feltéve, hogy van két hidrogénmolekula (mindegyik két atomból álló egység), amellyel reakcióba léphet. Tehát két molekula hidrogén és egy molekula oxigén szükséges két molekula víz előállításához. A reakciót pontosan kifejezi:

Az egyenlet mindkét oldalán ugyanannyi atomtípus van: a kémiai egyenlet egyensúlyban van, így a nyilat most már helyettesíthetjük egyenlőségjellel.
Az egyenlet bal oldalán lévő hidrogénmolekulák és a jobb oldalon lévő vízmolekulák ismétlődésének elkerülése érdekében egy utolsó tisztítás, ha H2 + H2 helyett 2H2-vel ábrázoljuk őket. Így a kiegyensúlyozott kémiai egyenlet a következő lesz:

Ez a 22. ábrán diagrammatikusan látható.

A kémiai egyenletek nagyon tömören nemcsak azt mutatják meg, hogy mely atomok és molekulák reagálnak egymással a termékek kialakulásához, hanem azt is, hogy az egyes atom- és molekulafajtákból hány darab vesz részt. Fontos megjegyezni, hogy a molekula előtti szám az adott molekula számát jelenti. Például a 3H2O három vízmolekulát jelent, ami összesen hat hidrogén- és három oxigénatomot jelent.
A kémiai egyenleteknek egyensúlyban kell lenniük; az egyenlet mindkét oldalán az egyes elemtípusok atomjainak számának egyenlőnek kell lennie.
Most már tudod, hogyan kell “olvasni” vagy értelmezni egy kémiai egyenletet – és hogyan ábrázol egy kémiai folyamatot. A vegyészek azonban abban is nagyon jártasak, hogy kémiai egyenleteket írjanak, mint egyfajta gyorsírást a különböző kémiai folyamatok vagy reakciók leírására. A kémiai egyenletek írása olyan, mint bármely idegen nyelv írása – gyakorlásra van szükség ahhoz, hogy folyékonyan elsajátítsuk. Valahol azonban minden kezdő tudósnak el kell kezdenie, és az alábbi szakasz egy nagyon ismerős kémiai reakció segítségével mutatja be, hogyan kell ezt megtenni. Ha ellenőrizni szeretné, hogy szükséges-e ezt a részt tanulnia, először próbálja ki a 20. kérdést.