Ez a szerkezet akkor jön létre, amikor egy polipeptidlánc két (vagy több, pl. ψ-hurok) szegmense átfedi egymást és hidrogénkötések sorát képezi egymással. Ez történhet párhuzamos elrendeződésben:

Vagy antipárhuzamos elrendeződésben:
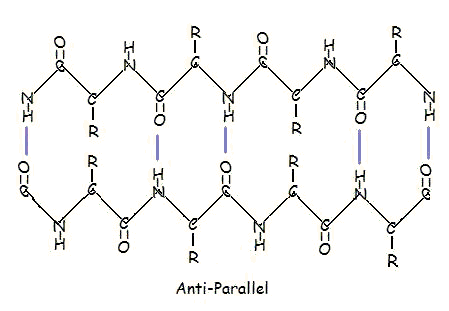
A párhuzamos és antipárhuzamos elrendeződés a polipeptidlánc irányultságának közvetlen következménye. Antiparallel elrendeződésben az egyik szegmens C-terminális vége ugyanazon az oldalon van, mint a másik szegmens N-terminális vége. Párhuzamos elrendezésben a C-terminális vége és az N-terminális vége mindkét szegmens esetében ugyanazon az oldalon van. A “hajtás” az aminosavak közötti peptidkötések váltakozó síkjai miatt jön létre; az egymással szemben lévő szegmensek egymáshoz igazított amino- és karbonilcsoportjainak orientációja váltakozva fordul egymás felé, illetve ellentétes irányba.
A párhuzamos elrendezés kevésbé stabil, mert az egyes aminosavmolekulák geometriája arra kényszeríti a hidrogénkötéseket, hogy ferdén alakuljanak ki, így azok hosszabbak és ezáltal gyengébbek lesznek. Ezzel szemben az antipárhuzamos elrendezésben a hidrogénkötések közvetlenül egymással szemben helyezkednek el, ami erősebb és stabilabb kötéseket eredményez.
Az antipárhuzamos béta-lap gyakran akkor alakul ki, amikor egy polipeptidlánc élesen megfordítja az irányát. Ez két egymást követő prolin-maradék jelenlétében fordulhat elő, amelyek egy szögletes csomót hoznak létre a polipeptidláncban, és visszahajlítják azt önmagára. Ez nem szükséges a polipeptidlánc távolabbi szegmensei esetében a béta-lapok kialakulásához, de a közeli szegmensek esetében ez határozott követelmény. Rövid távolságok esetén a béta-plezett lap két szegmensét 4+2n aminosavmaradvány választja el egymástól, ahol 4 a minimális maradékszám.