Gondolkoztál már azon, hogy miért világítanak a világító rudak (lásd az 1. ábrát), miután meghajlítottad őket? Vagy hogy miért világítanak azok a műanyag csillagok éjszaka is, miután lekapcsoltad a villanyt? Talán mégsem. Azonban akár feltette magának ezeket a kérdéseket, akár nem, a következő szöveg remélhetőleg választ és magyarázatot ad az izzó karkötők, a fénylő medúzák, a fekete fény és még sok más jelenségre.

1. ábra. Izzó pálcikák.
Lumineszcencia
Az összes fent említett jelenségben fellépő izzást általában lumineszcenciának nevezzük. A lumineszcencia egy anyag által fény formájában felszabaduló energia . A lumineszcenciának több fajtája különböztethető meg:
- Egyik példa a kemilumineszcencia. Egyes kémiai reakciók során az energia fény formájában szabadul fel. Ez történik egy izzópálca meghajlítása után. Ez az oka az olyan állatok, mint a medúzák vagy egyes mikroorganizmusok világításának is. Ebben az esetben biolumineszcenciának nevezik .
- Egy másik fajtája a tribolumineszcencia. Ez akkor figyelhető meg, ha egy öntapadós borítékot teljes sötétségben nyitnak ki, vagy ha egy ragasztószalagot sötét szobában tekernek le. Ilyenkor mechanikai energia kerül a rendszerbe, amely a világítás aktiválójaként szolgál .
- A lumineszcencia talán legismertebb fajtája a fotolumineszcencia. Itt az energiát elektromágneses sugárzás szolgáltatja, például napfény vagy ultraibolya lámpa révén, mint egyes diszkókban. Ez olyan jelenségeket okoz, mint a műanyag csillagok folyamatos ragyogása vagy a fehér ruhák extrém fényessége fekete fényben. Megkülönböztethetjük a fluoreszcenciát és a foszforeszcenciát, amit alább ismertetünk .
Mi az elektronikusan gerjesztett állapot?
Általában a lumineszcencia minden fajtája úgynevezett fotofizikai folyamatokon alapul. Általában magukat a molekulákat nevezik fluoreszkálónak. Ez a helyzet az olyan fluoreszcens festékekkel, mint a fluoreszcein vagy a kurkumin . A fotofizikai folyamatok magyarázatához azonban a molekulárisnál is kisebb szinten kell vizsgálódnunk.
A különböző elemek atomjai különböző számú elektronokkal rendelkeznek, amelyek több héjra és orbitálra vannak elosztva. Az elektronok egyfajta elemi részecskék. Az elektronátmenetek felelősek a lumineszcenciáért . Amikor a rendszer energiát vesz fel, az elektronok gerjesztődnek és magasabb energiájú állapotba emelkednek. A gerjesztés előtt, az alapállapotban az elektronok egy része az úgynevezett HOMO-ban (Highest Occupied Molecular Orbital) van. Miután elérték a gerjesztett állapotot, a LUMO-ban (Lowest Unoccupied Molecular Orbital) vannak (lásd a 2. ábrát). Hogy ez pontosan hogyan működik, azt a fotolumineszcencia mint konkrét példa segítségével fogjuk elmagyarázni.

2. ábra. Elektronikus gerjesztés.
Az atom vagy molekula különböző energetikai állapotait “energiaszinteknek” nevezzük. A molekulától és az atomtól függően az elektronok csak diszkrét energiaszinteket foglalhatnak el, mivel az energia kvantált, ami azt jelenti, hogy energiát csak bizonyos mennyiségben lehet elnyelni és kibocsátani . Két szint közötti különbség kiszámítható az 1. egyenlet segítségével (ahol E2 a magasabb energiaszint, E1 pedig az alacsonyabb).
(1) ΔE = E2-E1
A fotonoknak, a részecskéknek, amelyekből az elektromágneses sugárzás vagy a fény áll, bizonyos energiaértékkel kell rendelkezniük ahhoz, hogy elektronokat gerjeszthessenek. A foton energiája a 2. egyenlet segítségével számítható ki, ahol h a Planck-állandó, ν pedig a fény frekvenciája.
(2) Efoton = hν
Az elektronok számára szükséges gerjesztési energia egyenlő az energiaszintek közötti különbséggel. Csak bizonyos energiájú, és ennek megfelelően bizonyos frekvenciájú és hullámhosszúságú fény képes elektronok gerjesztésére . Az 1. és 2. egyenlet kiegyenlítésével, valamint a 3. egyenlet segítségével (ahol c a fénysebességet jelöli) kiszámítható a szükséges frekvencia és hullámhossz (lásd a 4. egyenletet) . Sok esetben UV-sugárzást használnak gerjesztésre.
(3) λ = c/ν
(4) ΔE = Ephoton ⇔ E2 – E1 = hν
ν = (E2 – E1)/h
λ = hc/(E2 – E1)
Elektronikusan gerjesztett állapotok deaktiválása
Az ilyen elektronikusan gerjesztett állapotok instabilak. Az elektronok visszahullnak alapállapotukba. Ugyanakkor a gerjesztési energia ismét felszabadul. Megkülönböztetünk sugárzó és nem sugárzó bomlási folyamatokat. A legtöbbször a bomlás nem sugárzásos, például rezgési relaxáció, a környező molekulákkal való elfojtás vagy belső konverzió (IC) révén. Ezeket a folyamatokat később részletesen kifejtjük.
Néha előfordulhat sugárzó bomlás fluoreszcencia és foszforeszcencia formájában. Az energia elektromágneses sugárzás vagy fotonok formájában bocsátódik ki. A kibocsátott fény hosszabb hullámhosszú és alacsonyabb energiájú, mint az elnyelt fény, mivel az energia egy része már felszabadult egy nem sugárzási bomlási folyamat során . Ez az oka annak, hogy nem látható UV-sugárzással történő gerjesztéssel a látható spektrumban történő emissziót lehet elérni. Ezt a hosszabb hullámhossz felé történő eltolódást Stokes-eltolódásnak nevezzük .
Összehasonlítás: Fluoreszcencia vs. foszforeszcencia
A fluoreszcencia és a foszforeszcencia egyaránt az elektromágneses sugárzás spontán emissziója. A különbség az, hogy a fluoreszcencia izzása a gerjesztő sugárzás forrásának kikapcsolása után azonnal megszűnik, míg a foszforeszcencia esetében a másodperc törtrészeitől akár órákig tartó utófénylés is előfordulhat .
A két jelenség mögött álló fotofizikai folyamatok összehasonlításához van néhány, a megértést segítő tény az elektronokról: Az elektronok olyan részecskék, amelyeknek van egy úgynevezett spinjük és egy spin kvantumszámuk. Ennek két különböző értéke lehet, nevezetesen +1/2 vagy -1/2 . Ez a szám egy olyan tulajdonság, amelyet valójában nem tudunk elképzelni vagy könnyen leírni. Gyakran hasonlítják egy forgó tetejéhez, amely vagy az óramutató járásával megegyező, vagy az óramutató járásával ellentétes irányban forog. Ez a leírás azonban sem matematikailag, sem fizikailag nem teljesen helytálló. Egy atom egyetlen orbitálisában lévő két elektron spinje antipárhuzamos, amit (↓) .
Fluoreszcencia
A fluoreszcencia Jablonski-diagramján (lásd a 3. ábrát) az S0 szingulett spinállapot az elektronok alapállapota, az S1 és S2 pedig a szingulett gerjesztett állapotok (az állapotok csak példaként szerepelnek ebben a szövegben, és nem feltétlenül vonatkoznak bizonyos atomokra, molekulákra stb.) Ezeken az állapotokon belül több energiaszint létezik. Minél magasabb a szint, annál több energiával rendelkezik egy elektron, amikor azon a szinten tartózkodik. A szingulett állapotok esetében az elektronok antiparallel spinnel rendelkeznek.

3. ábra. Jablonski-diagram a fluoreszcenciához.
Az elektronok például az S0 alapállapotból az elektromágneses sugárzás hatására gerjesztett S2 második gerjesztett állapot egyik energiaszintjére emelkednek. A gerjesztés megszűnése után az elektronok csak rövid ideig (kb. 10-15 s) maradnak ebben a gerjesztett állapotban, majd azonnal elkezdenek visszaesni az alapállapotba . Ennek során kezdetben rezgési relaxáció révén energia szabadulhat fel a környezet felé. Ez azt jelenti, hogy az atom vagy molekula mozgásával hőenergia szabadul fel addig, amíg a második gerjesztett állapot legalacsonyabb szintjét el nem éri.
A második és az első gerjesztett állapot közötti nagyobb szakadékot belső átalakulással hidaljuk át. Ez két állapot közötti elektronikus átmenetet ír le, miközben az elektronok spinje megmarad. Most az elektronok további rezgési relaxáció következtében tovább relaxálhatnak, amíg el nem érik az S1 állapot legalacsonyabb energiaszintjét.
Az elektronok elméletileg még tovább relaxálhatnak nem sugárzási úton, amíg végül ismét elérik az alapállapotot. Előfordulhat azonban, hogy az utolsó energiamennyiség túl nagy ahhoz, hogy a környezetbe távozzon, mert a környező molekulák nem képesek ekkora energiát elnyelni. Ekkor fluoreszcencia lép fel, ami egy bizonyos hullámhosszal rendelkező fotonok emissziójához vezet. Az emisszió csak addig tart, amíg az elektronok vissza nem térnek az alapállapotba. Mivel mindezen átmenetek során az elektronok spinje változatlan marad, ezért ezeket spinmentesnek nevezzük.
Foszforeszcencia
A foszforeszcencia esetében a dolgok egy kicsit másképp alakulnak (lásd a 4. ábrát). Itt is van egy S0 alapállapot és a két gerjesztett állapot, S1 és S2. Ezenkívül van egy gerjesztett triplett T1 állapot, amely energetikailag az S0 és S1 állapot között helyezkedik el. Az elektronoknak az alapállapotban ismét antiparallel spinek vannak.
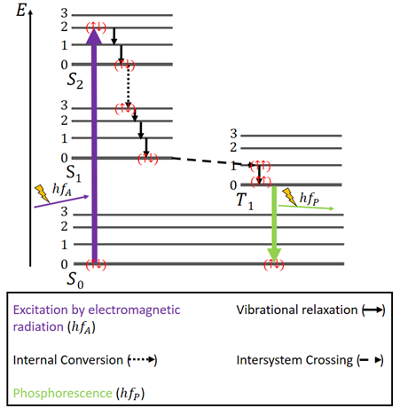
4. ábra. Jablonski-diagram a foszforeszcenciához.
A gerjesztés ugyanúgy történik, mint a fluoreszcenciában, azaz elektromágneses sugárzás révén. Az energia felszabadulása rezgési relaxáció és belső konverzió révén, azonos spin megtartása mellett itt is ugyanúgy történik, de csak az S1 állapot eléréséig.
A szingulett állapotok mellett létezik egy triplett állapot is, és úgynevezett rendszerközi kereszteződés (ISC) is létrejöhet, mivel a T1 állapot energetikailag kedvezőbb, mint az S1 állapot. Ez az átmenet, akárcsak a belső konverzió, két gerjesztett állapot közötti elektronikus átmenet. A belső konverzióval ellentétben azonban az ISC szingulettből triplettbe történő spinfordulással jár. A triplett állapotban lévő elektronok spinjei párhuzamosak, amit () -ként jegyeztek meg. Ezt az ISC folyamatot “spin-tiltottnak” nevezik. Nem teljesen lehetetlen – a “spin-orbit csatolás” nevű jelenség miatt -, azonban meglehetősen valószínűtlen .
A T1 állapotban a nem-sugárzó bomlás is lehetséges. A triplett állapot legalacsonyabb energiaszintje és az S0 állapot közötti átmenet azonban nem könnyen lehetséges, mert ez az átmenet is spin-tiltott. Mégis, kis eséllyel mégis megtörténhet. Elég gyenge fotonemissziót okoz, mert az elektron spinjét újra meg kell fordítani. Az energia ebben az állapotban egy ideig csapdába esik, és csak lassan szabadulhat fel. Miután minden energia felszabadult, az elektronok ismét alapállapotba kerülnek .
Következtetés
A spin által megengedett és tiltott folyamatok magyarázatul szolgálnak a fluoreszcencia azonnal megszűnő izzására és a foszforeszcencia utófényére. A foszforeszcencia általában csak “nehezebb” molekuláknál fordul elő, mivel a spint spin-orbit-kapcsolás segítségével meg kell fordítani. Az, hogy elektromágneses sugárzás egyáltalán kibocsátásra kerül-e, és milyen hullámhosszal, attól függ, hogy előzetesen mennyi energia szabadul fel nem sugárzó bomlással . Ez függ a molekulákat körülvevő, nagyobb mennyiségű energiát felvenni képes ún. kioltók tulajdonságaitól is.
Minden olyan folyamat, amely a sugárzási bomlások gátlásához vezethet, fluoreszcencia kioltást okozhat. Ilyenek például a nem sugárzási bomlási folyamatok, de a fluoreszcens molekula pusztulása is . A kvantumhatásfok a folyamat hatékonyságát írja le, és az elnyelt és a kibocsátott fotonok arányaként definiálják . Ez a tulajdonság minden anyag esetében más és más.
Még ha ez a szöveg a fotolumineszcenciára összpontosít is, a fotofizikai folyamatok a lumineszcencia minden típusánál azonosak .
Alkalmazások
Az olyan termékek mellett, mint a világító rudak, a fluoreszcenciát és a foszforeszcenciát sok más módon is használják. További példák a vészkijárathoz vezető útjelző oszlopok, amelyeknek nincs szükségük elektromos ellátásra, de éjszaka a foszforeszcencia miatt világítanak. Még a növények is fluoreszkálhatnak: A spenótot a nanotechnológia segítségével úgy lehet módosítani, hogy a talajvízben lévő robbanóanyagok nyomait kimutassa. A levelek szén nanocsöveket tartalmaznak, amelyekhez nitroaromatikumok tudnak kötődni. Ha ez megtörténik, a növény fluoreszcens jelet bocsát ki, amely infravörös kamerákkal detektálható .
A videó a lumineszcencia különböző típusait mutatja be. A bal oldalon a kurkuma fűszerben található kurkumin nevű festékanyag fluoreszcenciáját mutatja UV-fényben . A kurkumin alkoholban van feloldva, hogy a fluoreszcencia láthatóvá váljon.
A műanyag pók és a kis csőben lévő vegyület a foszforeszcencia példája. A csőben található stroncium-aluminátot kezdetben UV-sugárzás gerjeszti, és végül zöld fényt bocsát ki. Ennek oka az olyan elemekkel való adalékolás, mint az európium, ami a vegyületet lumineszcens pigmentként használhatóvá teszi .
A világító rúd meghajlítása (a jobb oldalon) kémiai reakciót indít el a hidrogén-peroxid és egy festékanyag, valamint a fenil-oxalát között. Megfigyelhető a kemilumineszcencia.
Video 1. Fluoreszcencia, foszforeszcencia és kemilumineszcencia összehasonlításban.
K. Arnold et al., Chemie Oberstufe (németül), Cornelsen Schulverlage, Berlin, 2015, 496-497. ISBN: 978-3-06-011179-4
Lexikon der Physik: Lumineszenz (németül), spektrum.de. (hozzáférés: 2017. január 25.)
D. Wiechoczek, Wenn Mineralien selber leuchten – Phosphoreszenz, Fluoreszenz und Lumineszenz (németül), chemieunterricht.de 2010. (hozzáférés: 2017. január 25.)
Lexikon der Physik: Photophysikalische Prozesse (németül), spektrum.de. (hozzáférés: 2017. január 27.)
D. Wiechoczek, Chemie mit Curry (németül), chemieunterricht.de 2015. (hozzáférés: 2017. január 27.)
P. W. Atkins, J. de Paula, Kurzlehrbuch Physikalische Chemie (német nyelven), Wiley-VCH, Weinheim, 2008, 853ff., 921ff. ISBN: 978-3-527-31807-0
P. W. Atkins, Physical Chemistry, Oxford University Press, 1994, 591ff.
Quantelung (németül), chemie.de. (hozzáférés: 2017. január 27.)
Bohr-féle frekvenciaviszony (németül), chemgapedia.de. (hozzáférés: 2017. január 25.)
Ilmenaui Műszaki Egyetem, Fizikai kémia II. gyakorlat: Fizikai kémia/Mikroreakciótechnika, Fluoreszcencia-oltási kísérlet (németül), tu-ilmenau.de. (hozzáférés: 2017. január 27.)
Stokes shift (németül), chemie.de. (hozzáférés: 2017. január 25.)
Elektronspin (németül), chemie.de. (hozzáférés: 2017. január 27.)
Quantum yield (németül), chemie.de. (hozzáférés: 2017. január 27.)
Spenót robbanóanyagot mutat ki a talajvízben (németül), Spiegel Online, 2016. november 1. (hozzáférés: 2017. január 27.)
D. Weiß, Phosphorescence (németül), chemie.uni-jena.de. (hozzáférés: 2017. január 27.)
 Kim Dreier a lemgói Marianne-Weber-Gimnázium (középiskola) tanulója.
Kim Dreier a lemgói Marianne-Weber-Gimnázium (középiskola) tanulója.