Introduction
Az emberi agy a kognitív fejlődés elősegítése érdekében az élet során kiterjedt érésen megy keresztül. Az axonok myelinizációja az egész idegrendszerben az egyik ilyen kulcsfontosságú érési folyamat. A központi idegrendszerben (CNS) az oligodendrocitáknak nevezett gliasejtek számos nyúlványt nyúlnak ki a környezetükbe, amelyek koncentrikusan membránt tekernek az axonok köré, hogy mielinhüvelyt képezzenek. A mielinhüvelyek lehetővé teszik az akciós potenciálok gyors sós vezetését azáltal, hogy feszültségvezérelt Na+ csatornákat lokalizálnak a szomszédos hüvelyek közötti rövid résekbe (az úgynevezett Ranvier-csomópontokba), és elektromos szigetelőként működnek. A hosszában teljesen myelinizált axonok sokszor gyorsabban vezetnek impulzusokat, mint az azonos keresztmetszetű, myelinizálatlan axonok (Waxman, 1980). Ezért a myelinizált idegi áramkörök sokkal gyorsabban vezetik az információt, mint a myelinizálatlan áramkörök. Az ember gyakorlatilag myelinizálatlan CNS-szel születik, és az oligodendrocyta-populáció a születést követően drámaian megnövekszik, és a gyermekkor első néhány évében széleskörű myelinizációra kerül sor. A myelinizáció a serdülőkorban és a felnőttkorban jellegzetes tér-időbeli módon folytatódik, és korrelál a megfelelő áramköri működés kialakulásával és fenntartásával. A fehérállomány (a központi idegrendszer myelinben gazdag területei) érése például párhuzamosan zajlik a gyermekkori kognitív folyamatok, például az információfeldolgozási sebesség fejlődésével (Mabbott és mtsai., 2006; Scantlebury és mtsai., 2014). Emellett a mielin patológiája/abnormalitása nemcsak a szklerózis multiplex demielinizáló betegségben, hanem számos neurodegeneratív betegségben (Kang et al., 2013; Huang et al., 2015) és neurofejlődési rendellenességben is megfigyelhető (Takahashi et al., 2011). Az egyes axonok myelinizációja azonban nem egy “mindent vagy semmit” jelenség. A CNS-ben lévő axonok széleskörű variációt mutatnak a mielinhüvelyek számában, hüvelyhosszában, hüvelyvastagságában és hosszuk mentén való eloszlásában. A mielinizációnak számos különböző mintázata létezik; például a fiatalkori és felnőtt egérkéregben ritkán mielinizált régiókkal rendelkező axonokat írtak le (Tomassy és mtsai., 2014; Hill és mtsai., 2018; Hughes és mtsai., 2018). Ezen hüvelyparaméterek bármelyikének módosítása kiszámítható hatással van az alapul szolgáló axon vezetési sebességére – ezért az axon mentén a myelinizáció specifikus mintázatának kialakítása különösen fontos lehet az áramkör funkciójának finomhangolásához. Például a futóegerek halló agytörzsének axonjai a disztális régiók mentén fokozatosan rövidebb myelinhüvelyeket mutatnak, hogy biztosítsák a jelek megérkezésének pontos időzítését a hangok lokalizációjának megkönnyítése érdekében (Ford és mtsai., 2015). Az axon mentén a myelinizáció általános mintázatának finom változásai (akár új myelin hozzáadásával, akár a meglévő myelin átalakításával) alapvetően megváltoztathatják az idegimpulzusok időzítését az áramkörökben. Ha a mielin adaptálható, akkor a mielinizáció ilyen mintázatainak módosítása erőteljes mechanizmust jelenthet az áramkörök működésének szabályozásában az egész élet során.
A legújabb bizonyítékok arra utalnak, hogy a mielin adaptálható az áramkörök aktivitására adott válaszként. A teljes agyi diffúziós tenzor képalkotás felhasználható a myelinben gazdag fehérállomány időbeli széles körű változásainak mérésére – ilyen kísérletek embereken és rágcsálókon kimutatták, hogy egy új feladat megtanulása korrelál a fehérállomány változásával a releváns agyi régiókban (Scholz et al., 2009; Sampaio-Baptista et al., 2013). Az állatmodellekben végzett sejtszintű elemzések azt mutatják, hogy a hatékony motoros tanuláshoz új mielinizáló oligodendrociták termelődése szükséges (McKenzie et al., 2014; Xiao et al., 2016). Jelenleg feltételezik, hogy az idegi áramkörök aktivitása változásokat válthat ki a mielinben; kiterjedt kutatások bizonyították, hogy az idegi aktivitás befolyásolhatja az oligodendrocita prekurzor sejtek (OPC-k) proliferációját, az oligodendrociták differenciálódását, valamint a mielinhüvelyek kialakulását és növekedését. Ezeket a kutatásokat, beleértve az érintett molekuláris jelek bizonyítékait is, máshol részletesen áttekintettük (Fields, 2015; Almeida és Lyons, 2017; Mount és Monje, 2017). A neuronális aktivitás változásokat indíthat el a mielinben, ami viszont megváltoztathatja a vezetési sebességet, hogy finomhangolja az áramkörök működését megalapozó időzítéseket.
Még mindig nem tudjuk azonban, hogy az áramkörök mielinizációja az élet során dinamikusan szabályozódik-e vagy hogyan. Rágcsálókon végzett munkák azt jelzik, hogy új oligodendrociták keletkeznek az egész CNS-ben még felnőttkorban is (Young és mtsai., 2013), és az OPC-k valóban megtalálhatóak az emberi felnőtt agyban (Chang és mtsai., 2000). Emberi szövetek széndioxiddal végzett elemzései felnőttkori oligodendrocitákat azonosítottak a kéregben, bár ugyanezek az elemzések azt mutatták, hogy a corpus callosumban lévő oligodendrociták többsége kora gyermekkorban keletkezik (Yeung és mtsai., 2014). Az embereken végzett neuroimaging vizsgálatok, amelyek a fehérállomány szerkezeti változásait a feladattanulással korrelálják, azonban arra utalnak, hogy az új mielin egész életen át képződhet. Az ilyen elhúzódó myelinizációhoz elvileg egész életen át tartó oligodendrocita termelésre lenne szükség, mivel az egyes myelinizáló oligodendrocitáknak korlátozott, mindössze néhány órás időablakuk van az új burokképződés megindítására (Watkins et al., 2008; Czopka et al., 2013), és az egy oligodendrocitára jutó burokszám idővel stabilnak tűnik (Tripathi et al., 2017). A Mount és Monje (2017) által megjegyzett egyik fenntartás, hogy a széndatálási kísérletben a “születési” dátum (amely a sejtosztódás során a DNS-replikáció időpontját azonosítja) az OPC, és nem feltétlenül a differenciált oligodendrocita időpontját tükrözi. Ez fontos, tekintettel arra a bizonyítékra, hogy az OPC-k közvetlenül, sejtosztódás nélkül is képesek oligodendrocitákká differenciálódni, legalábbis rágcsálókban (Hughes és mtsai., 2013). A corpus callosumban lévő OPC-k közvetlenül oligodendrocitákká differenciálódhattak sok évvel a terminális sejtosztódásuk után; így ezen új oligodendrociták differenciálódásának ideje nem határozható meg karbon-datálással, és így Yeung és munkatársai (2014) talán alábecsülték az oligodendrociták termelődésének ütemét a felnőtt emberi agyban. Még sokat kell tanulnunk arról, hogy az oligodendrociták keletkezése és a mielin átalakulása milyen relatív mértékben járul hozzá a CNS fejlődéséhez az élet során.
Az oligodendrogenezis, a mielinképződés és a mielin átalakulás pontos dinamikájának teljes megértéséhez az élet különböző szakaszaiban a nagy felbontású longitudinális képalkotás jelenti az arany standard megközelítést. Itt áttekintést adunk a közelmúltban végzett in vivo képalkotó vizsgálatokról, amelyek kezdik tisztázni a mielinizáció dinamikáját, ami azt is lehetővé teszi számunkra, hogy elkezdjük megérteni, hogyan befolyásolhatja ez a dinamika az idegi áramkörök működését.
De novo myelinizáció
Az oligodendrociták keletkezésének, valamint a mielin képződésének és dinamikus átalakulásának in vivo módjának végleges feltárásához két közelmúltbeli vizsgálatban az egér szomatoszenzoros kéreg hosszabb időn keresztül történő ismételt kétfotonos képalkotását használták. Hughes és munkatársai (2018) transzgénikus riporter egerek kéregállományát képezték le fluoreszcensen jelölt oligodendroglia vonalú sejtekkel a korai felnőttkortól a közép- és időskoron át (körülbelül P720). Azt találták, hogy az oligodendrocita populáció tovább növekszik, és a fiatal felnőtt és középkorú stádiumok között a kérgi oligodendrocita sűrűség majdnem megduplázódik (1A. ábra). Ezt a kérgi mielinhüvelyek számának több mint kétszeres növekedése kísérte. De hogyan növekszik az oligodendrociták száma? A korai, születés utáni fejlődés során sok oligodendrocita termelődik, de csak egy részhalmaza marad életben és megy tovább az axonok mielinizálásába (Barres és mtsai., 1992). Ez felnőttkorban is hasonlónak tűnik – Hughes és munkatársai (2018) az egyes agykérgi OPC-ket a felnőtt kéregben akár 50 napon keresztül követve kimutatták, hogy az újonnan differenciálódott oligodendrociták többsége sejthalálon megy keresztül, és csak 22%-uk marad életben és kötődik myelinizációhoz (1B ábra). Továbbra is ismeretlen, hogy az újonnan differenciálódott oligodendrociták mekkora hányada keletkezik OPC osztódást követően, szemben a közvetlen differenciálódással. Ha azonban az oligodendrociták egyszer már elkötelezték magukat a mielinizáció mellett, stabilak maradnak, és az 50 napos képalkotási időszak alatt nincs bizonyíték arra, hogy a mielinizáló oligodendrociták sejthalált szenvednének.
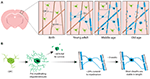
1. ábra. Oligodendrociták és mielin dinamikája az emlősök kéregállományában az élet során. (A) Az oligodendrocita prekurzor sejtek (OPC) folyamatosan új mielinizáló oligodendrocitákat (OL) hoznak létre a szomatoszenzoros kéregben a születéstől a középkorig. Az OL-populáció aztán idős korban csökken, ami a mielinborítás csökkenésével jár. (B) Az egyes OPC-k vonalkövetése azt mutatja, hogy bár a premyelinizáló OL-ok felnőttkorban folyamatosan termelődnek, csak körülbelül 20%-uk éli túl a myelinizációt. A legtöbb myelinhüvely, ha egyszer kialakult, hosszú időn keresztül stabil hosszúságú, ami azt jelzi, hogy a meglévő myelin rendszerint nagyon kevéssé átalakul. Hill és munkatársai (2018) és Hughes és munkatársai (2018) adatainak összefoglalása.
Hasonlóan Hill és munkatársai (2018) az oligodendrociták transzgénikus riportereit és a jelölésmentes spektrális konfokális reflektancia (SCoRe) mikroszkópiás technikát használták az axonok mentén elhelyezkedő mielin (Schain és munkatársai, 2014) leképezésére juvenilis, fiatal felnőtt, középkorú és idős egerek (P950) szomatoszenzoros kéregében. Azt is megállapították, hogy az oligodendrociták száma felnőttkorban P650-ig tovább növekszik, és hogy az oligodendrociták középkorban 80 napig stabilak a képalkotás során. Azt találták, hogy a kéreg myelinizációja szintén középkorban, P650-nél éri el a csúcspontját, és hogy az oligodendrociták sűrűsége jelentősen csökken a csúcspontjától (P650-nél) egészen a nagyon idős korig (P950) (1A. ábra). Ez tükröződött az I. agykérgi réteg axonjainak myelinfedettségének csökkenésében P650 és P950 között. A hosszú távú oligodendrocita túlélés a CNS különböző részein eltérő lehet. Tripathi és munkatársai (2017) egerekben P60-ban jelölték meg a mielinizáló oligodendrocitákat, majd megszámolták, hogy hány jelölt sejt maradt életben P605-ig több CNS-régióban. Azt találták, hogy a gerincvelőben és a motoros kéregben a P60-ban jelölt sejtek 60-70%-a, míg a corpus callosumban a P60-ban jelölt sejtek több mint 90%-a maradt életben. Az oligodendrociták számának és a myelinizációnak az életkor előrehaladtával történő csökkenése bizonyos CNS-régiókban érdekes kérdéseket vet fel a myelinvesztésnek az életkorral összefüggő kognitív hanyatlásban játszott szerepével kapcsolatban. Az MRI-elemzések azt mutatják, hogy a fehérállomány mikrostruktúrája korrelál a folyékony intelligenciával (Ritchie és mtsai., 2015), de azt is, hogy ez a fehérállomány mikrostruktúra az életkor növekedésével romlik (Cox és mtsai., 2016). Az életkorral összefüggő későbbi myelinvesztés a myelinizált áramkörök diszregulációja miatt csökkent kognitív funkciókhoz vezethet.
Az új oligodendrociták (és később az új myelin) generációja a felnőtt kéregben reagálhat az áramkörök aktivitására? Korábbi kutatások kimutatták, hogy a szenzoros bemenet csökkentése az egerek bajszának eltávolításával csökkent oligodendrogenezishez vezet a szomatoszenzoros kéregben (Hill és mtsai., 2014). Ennek további vizsgálatára Hughes és munkatársai (2018) felnőtt (P365) egereket 3 héten keresztül szenzoros stimulációval láttak el úgy, hogy gyöngyöket akasztottak az állatketrecekbe, hogy ismételten stimulálják a bajszukat és ezáltal a szomatoszenzoros kérget. A szomatoszenzoros kéreg képalkotásával a 3 hét előtt és után kimutatták, hogy az érzékszervi stimuláció növeli az oligodendrociták számát, ami valószínűleg az újonnan differenciálódott sejtek fokozott túlélésének köszönhető. Kougioumtzidou és munkatársai (2017) további bizonyítékot szolgáltattak arra, hogy az áramkörök aktivitása fontos lehet a sejtek túlélésének szabályozásában – kimutatták, hogy az AMPA receptor 2, 3 és 4 alegységek elvesztése az OPC-kben az oligodendrociták csökkent túléléséhez vezet. Ez arra utal, hogy a de novo myelinizációt az agykérgi áramkörök aktivitása egész életen át modulálhatja, talán ugyanezen áramkörök működésének finomhangolása érdekében.
Még sok kérdés vár megválaszolásra: milyen hatással van az oligodendrogenezis és az új myelinizáció a tényleges áramköri működésre? A neuronális aktivitás fokozza-e a mielinizáló oligodendrociták hosszú távú túlélését? Lehetséges, hogy az oligodendrociták időskori elvesztése a neuronális aktivitás korral összefüggő csökkenésének köszönhető, ami viszont hatással lehet az oligodendrociták általános túlélésére. Az is lehet, hogy az oligodendrociták élettartama a neuronális aktivitástól függetlenül korlátozott (vagy belsőleg programozott, vagy az öregedéssel összefüggő egyéb külső jelek által befolyásolt). Mindkét esetben az áramköri stimuláció segíthet enyhíteni az életkorral összefüggő mielinvesztést azáltal, hogy vagy elősegíti a meglévő oligodendrociták túlélését, vagy serkenti az új oligodendrociták termelődését. Ennek viszont jelentős következményei lehetnek az életkorral összefüggő kognitív hanyatlás kezelésében és megelőzésében.
Az aktivitás által közvetített oligodendrogenezis nem korlátozódik a szomatoszenzoros kéregre – a motoros tanuláson átesett fiatal felnőtt egereknél a motoros kéregben az újonnan differenciálódott oligodendrociták számának növekedése is megfigyelhető (Xiao et al., 2016). Mi a helyzet a központi idegrendszer más területeivel? Számos agykérgi axon a corpus callosumon keresztül vetül ki, ezért az agykérgi áramkörök stimulálása mind az agykérgi, mind a callosal OPC-knek jelezhet. Két rágcsálókon végzett vizsgálat bizonyította, hogy a kérgi neuronok stimulálása oligodendrogenezist indukál a corpus callosumon belül. Gibson és munkatársai (2014) optogenetikusan stimulálták az V. réteg projekciós neuronjait a premotoros kéregben, és az OPC-proliferáció növekedését találták mind a premotoros kéregben, mind a corpus callosumban. Ez az oligodendrociták számának és hüvelyvastagságának növekedéséhez vezetett 4 héttel a stimuláció után. Nemrégiben Mitew és munkatársai (2018) kizárólag dizájner drogokkal aktivált dizájner receptorokat használtak a 2/3-as réteg szomatoszenzoros neuronjainak stimulálására, és szintén megnövekedett OPC-proliferációt, oligodendrogenezist és vastagabb mielinhüvelyeket figyeltek meg a corpus callosumban mind a fiatal, mind a felnőtt egerekben. Azt is kimutatták, hogy az új oligodendrociták előszeretettel képeznek mielinhüvelyt az aktív axonokon. Ez azt jelzi, hogy az aktivitás által indukált de novo myelinizáció elvileg az aktív axonokat/áramköröket célozhatja meg. Továbbra is ismeretlen, hogy a neuronális aktivitásra adott válaszként a mielin milyen hosszú távú változásokat eredményezhet. A Tripathi és munkatársai (2017), Hill és munkatársai (2018), valamint Hughes és munkatársai (2018) által megfigyelt myelinizáló sejtek hosszú távú túlélése arra utal, hogy ha egy oligodendrocita egyszer már myelinhüvelyt képez, valószínűleg akkor is túlél, ha a neuronális aktivitás szintje visszatér az alapszintre. Az, hogy maguk a mielinhüvelyek megváltoznak-e, amint a neuronális aktivitás visszatér a normál szintre, az egyedi hüvelyek dinamikájának további vizsgálatát igényli, amelyet az alábbiakban tárgyalunk.
Ezért lehetséges, hogy az egész életen át tartó de novo myelinizáció számos olyan CNS-régióban előfordulhat, ahol a myelinizációra alkalmas axonok elegendő nem myelinizált térrel rendelkeznek. Továbbra sem világos azonban, hogy az oligodendrogenezis milyen mértékben folytatódik a felnőtt emberi agy különböző területein. Széndátum-elemzés azt sugallja, hogy a corpus callosum traktusban a legtöbb oligodendrocita a korai gyermekkorban keletkezik (Yeung és mtsai., 2014). Az emberi agyszövet immunhisztokémiai elemzése az újonnan differenciálódott oligodendrociták új markerével (BCAS1) a frontális kéregben új oligodendrocitákat mutat a középkoron túl is, de nagyon kevés új oligodendrocitát a fehérállományban a harmadik életévtized után (Fard és mtsai., 2017). Az oligodendrogenezisnek ez a fajonkénti különbsége a léptékből adódhat. Hughes és munkatársai (2013) rágcsálókra vonatkozó adatai arra utalnak, hogy az oligodendrociták óriási feleslegben keletkeznek, a sejtek közel 80%-ának folyamatos metszése mellett. Tekintettel egy ilyen folyamat energiaköltségére, fenntartható-e ez a mechanizmus az egész életen át egy olyan méretű szervben, mint az emberi agy? Lehet, hogy az emberi agyban korlátozott az oligodendrocita túltermelés, mert a nagyobb CNS hosszadalmasabb myelinizációjára van szükség, vagy mert az olyan jelek, mint a neuronális aktivitás, arra ösztönzik az OPC-ket, hogy szükség szerint oligodendrocitákká differenciálódjanak.
Myelin átalakítása
A meglévő myelinhüvelyek átalakítása megváltoztathatja a vezetési tulajdonságokat anélkül, hogy új oligodendrocitákat vagy myelint kellene létrehozni. A meglévő myelinhüvelyek hosszának megváltoztatása megváltoztathatja a myelin fedettségét az axon mentén és a Ranvier-csomópontok közötti távolságot (ami mindkettő hatással lenne a vezetési sebességre). Ezenkívül még a nagyon finom myelinátalakítás is megváltoztathatja maguknak a csomópontoknak a hosszát. Nemrégiben kimutatták, hogy a csomópontok hossza nagymértékben változhat a látóidegben és a kéregben, és hogy a csomópontok hosszának megváltoztatása egy axon mentén elvileg jelentősen megváltoztathatja a vezetési sebességet is (Arancibia-Cárcamo és mtsai., 2017). Azt, hogy a Ranvier-csomópontok változásait elsősorban a mielinizáció vagy magának az axonnak az átrendeződése vezérli-e, még meg kell határozni.
Mind Hill és munkatársai (2018), mind Hughes és munkatársai (2018) több héten keresztül végeztek longitudinális vizsgálatot az egyes mielinhüvelyeken egér szomatoszenzoros kéregben annak felmérésére, hogy a hüvelyhosszok dinamikusan szabályozódnak-e. Ez a vizsgálat a mielinhüvelyek hosszának dinamikus szabályozására irányult. Hill és munkatársai (2018) azt találták, hogy a korai felnőttkorban (P90-120), bár egyes hüvelyek hosszabbodást vagy zsugorodást mutatnak, a megfigyelt hüvelyek 81%-a stabil volt. Az életkor előrehaladtával több hüvely hossza stabilizálódhat; Hughes és munkatársai (2018) idősebb (P365) állatokban követték a hüvelyeket, és azt látták, hogy a hüvelyek 99%-a 3 hét alatt stabil maradt (1B ábra).
A hüvelyek hosszának hasonló stabilitását máshol is leírták; Auer és munkatársai (2018) lárva zebrahalak segítségével vizsgálták, hogy az egyes hüvelyek hossza idővel változhat-e, fluoreszcensen jelölt myelinhüvelyek időbeli élő képalkotásával. Azt találták, hogy az egyes hüvelyek a kialakulásukat követő első néhány napban gyors, de változó növekedésen mennek keresztül, mielőtt stabilizálódna a hüvelyhosszuk. Miután stabilizálódtak, a hüvelyek csak az állat általános növekedésének megfelelően növekednek tovább.
Miért változik egyes hüvelyek hossza a kéregben, míg másoké nem? Ez a különböző idegi áramkörök igényeinek különbözőségét tükrözheti. Axonális diverzitást figyeltek meg a kezdeti myelinizáció során a zebrahal gerincvelőben, ahol egyes axonok a szinaptikus vezikulák felszabadulását használják a myelinhüvelyek számának és hosszának szabályozására, míg mások nem (Koudelka és mtsai., 2016). Ez felveti azt az érdekes hipotézist, hogy csak néhány axon képes aktivitással kapcsolatos jelek révén szabályozni a mielint. Hughes és munkatársai (2018) azt találták, hogy szenzoros stimulációs paradigmájuk nem növelte a dinamikus hüvelyek arányát a szomatoszenzoros kéregben. Az axon altípusok diverzitásának részletesebb elemzése a hüvelyhossz dinamikájának longitudinális vizsgálatával párosulva azonban megerősíthetné, hogy a hüvelyhossz átalakulása specifikus-e bizonyos áramkörökre.
A hüvelyhossz stabilitása a hüvelyek átalakulásra való képtelenségét tükrözi? A zebrahalon végzett kísérletek arra utalnak, hogy a hüvelyhossz átalakulása kiváltható, ha az axon myelinizációs profilja megszakad. Auer és munkatársai (2018) egyes oligodendrocitákat abláltak, és így az axonok mentén ritkán eltávolították a köpenyeket. Azt találták, hogy amikor egy teljesen myelinizált axonon egyetlen myelinhüvelyt veszítünk el, a szomszédos hüvelyek gyors növekedést tudnak újraindítani, hogy fedezzék a myelinizálatlan rést. Számos esetben egy új mielinhüvely képződött elődje helyén, és még vissza is tudott tolódni a behatoló szomszédos burkokra, hogy visszaállítsa a mielinizáció eredeti mintázatát (2A. ábra). Ezért néha egy specifikus mielinizációs mintázat előnyösen megmarad, még a mielin megszakadása után is. Ez talán az alapul szolgáló axon optimális vezetési tulajdonságainak fenntartása érdekében történik. Auer és munkatársai (2018) ritkán myelinizált axonokat figyeltek meg a lárvális zebrahalban, ahogyan azt korábban a rágcsálók kéregállományában is azonosították. Érdekes módon azt találták, hogy az ilyen ritkán myelinizált axonok egyes burkainak ablációját követően gyakorlatilag az ablált burka helyén új burka képződött, még az axon egyébként myelinizálatlan szakasza mentén is (2B ábra). Úgy tűnik tehát, hogy a myelinizációs mintázatok a ritkán myelinizált axonok mentén a zebrahalakban is stabilan fennmaradnak, ahogyan azt Hill és munkatársai (2018) rágcsálóknál javasolták. A ritkás myelinizációs profilok funkciója továbbra is ismeretlen. Az ilyen mintázatok lehetővé tehetik az egyes axonok működésének dinamikusabb finomhangolását az idő múlásával, bár az is lehetséges, hogy az ilyen nem myelinizált rések megkönnyítik a fokozatos myelinizációt az áramkörökön belüli konzisztens vezetési idők fenntartása érdekében, ahogy az állat nő és/vagy az axonok hossza változik.
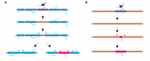
2. ábra. A mielin átalakulása in vivo is bekövetkezhet. (A) A teljesen myelinizált axonon lévő egyes köpenyek ablációja a szomszédos köpenyek gyors növekedését indukálhatja a rés fedezésére. Ezt a rést a szomszédos köpenyek vagy teljesen elfedik, vagy egy új köpeny hozzáadásával helyreállítható az eredeti myelinizációs profil. (B) Egy gyengén myelinizált axonon lévő hüvely ablációját egy új, az ablált előd hüvelyével azonos méretű és elhelyezkedésű myelinhüvely kialakulása követi. Auer és munkatársai (2018) adatainak összefoglalása.
A stabil mielinhüvelyek az emlősökben is rendelkeznek ezzel a képességgel az újramodellezésre, amikor a mielinizációs mintázat megszakad? A kérdés megválaszolásához további longitudinális vizsgálatokra van szükség demielinizációval párosítva. Lehetséges, hogy az ilyen átalakulást nem a neuronális aktivitás indukálja, hanem a mielinvesztés kompenzációs mechanizmusa. Az életkorral összefüggő oligodendrociták elvesztése kiválthatja a túlélő burok átalakulását, hogy fedje az axon denudált részeit, és így segítsen fenntartani az áramkör működését. A myelinhüvelyek élő képalkotása idős korban meghatározhatja, hogy ez így van-e.
Az itt tárgyalt élő képalkotó vizsgálatok mindegyike a myelinhüvely hosszának dinamikáját vizsgálta, de a myelinhüvely vastagságát nem. Lehet-e dinamikusan szabályozni a köpeny vastagságát? A PI3K/AKT/mTOR jelátvitel stimulálása felnőtt egerek oligodendrocitáiban további mielinburkolást vált ki a hüvely vastagságának növelése érdekében (Snaidero és mtsai., 2014). Ezt az áramköri aktivitás modulálhatja, mivel a neuronális stimuláció mind a juvenilis, mind a felnőtt egereknél a hüvelyvastagság növekedéséhez vezet (Gibson és mtsai., 2014; Mitew és mtsai., 2018). Ez rávilágít annak szükségességére, hogy az összes hüvelyparamétert longitudinálisan képezzük le a hüvely átalakulásának dinamikájának teljes megértéséhez. Az axonok mentén a hüvelyvastagság pontos méréséhez élő képalkotási módokra van szükség, mivel jelenleg ehhez keresztmetszeti mérésre van szükség elektronmikroszkópián keresztül, ami az elemzést egyetlen időpontra korlátozza. Néhány jelölésmentes képalkotó technika, például a harmadik harmonikus generációs mikroszkópia és a spektrális reflektometria ígéretesnek tűnik az ilyen mérések elvégzésére (Lim és mtsai., 2014; Kwon és mtsai., 2017). Ezeket a technikákat a rágcsálókéreg longitudinális vizsgálataival összekapcsolva meghatározható lenne, hogy a kialakult mielinhüvelyek képesek-e módosítani vastagságukat, vagy a neuronális aktivitás egyszerűen a de novo mielinizációt sürgetve vastagabb hurkokat hoz létre.
Úgy tűnik tehát, hogy bár a mielinhüvelyek képesek átalakulni, amikor a mielin megszakad, a legtöbb hurok általában stabil hosszúságú. Ez a stabilitás potenciálisan a korai kialakult, az áramkörök működéséhez optimalizált myelinizációs minták fenntartásának köszönhető.
A jövő
A legutóbbi emlősökön végzett képalkotó vizsgálatok a de novo myelinizációra és a köpenyek átalakulására összpontosítottak az agykérgi szürkeállományban. A kérgi áramkörök számos régión, például a gerincvelőn és a corpus callosumon keresztül kapnak és küldenek információt, így a myelin több különböző CNS-területen történő változása megváltoztathatja a jelátvitelt egyetlen áramkörben. A CNS-t hagyományosan a formaldehiddel történő fixálás utáni megjelenés alapján írják le, ahol a “fehér anyag” az erősen mielinizált axonális pályákat, míg a “szürke anyag” a neuronális sejttestekkel, dendritekkel és szinapszisokkal sűrűn telített területeket jellemzi. Ez az osztályozás azonban túlságosan leegyszerűsítő; az OPC-k mind a szürke, mind a fehér anyagban myelinizáló oligodendrocitákat termelnek (Dawson et al., 2003), és valójában egyre több bizonyíték van az oligodendrogliális vonal és a myelinizáció mintázatának változatosságára mind a szürke, mind a fehér anyagban (Rivers et al., 2008; Viganò et al., 2013; Young et al., 2013; Bechler et al., 2015). Ez a sokféleség tükrözheti a myelin egyedi követelményeit a CNS különböző területein, és potenciálisan különböző áramkörökön. További longitudinális képalkotó vizsgálatokra van szükség ahhoz, hogy jobban megértsük a de novo myelinizáció és a burkok átalakulásának dinamikáját a CNS-nek az agykéregen kívüli területein.
Míg a lárva zebrahal optikai átláthatósága lehetővé teszi a nem invazív élő képalkotást, az emlősök CNS-ében az ilyen kísérletek elvégzése invazívabb és technikailag nagyobb kihívást jelent. Hill és munkatársai (2018) és Hughes és munkatársai (2018) kétfotonos mikroszkópiát használtak koponya képalkotó ablakokkal, hogy akár 400 μm mélységig terjedő képet készítsenek a kéregben. Hasonló technikákat lehetne alkalmazni a gerincvelő felszíni myelinizált pályáinak időbeli leképezésére (Locatelli és mtsai., 2018), de a mélyebb CNS-régiókba nem lehet behatolni kizárólag kétfoton-mikroszkópiával. Az egyik alternatíva a kétfotonos mikroendoszkópia alkalmazása, ahol egy gradiens törésmutatójú (GRIN) lencsével ellátott mikroendoszkópos szondát vezetnek be a szövetbe, hogy az agy mélyebben fekvő sejtjeit leképezzék . Az endoszkóp behelyezése azonban gyulladásos reakciókhoz vezethet, amelyek hatással lehetnek a mielinizációra. Alternatív megoldás lehet a háromfotonos mikroszkópia a koponya képalkotó ablak módszerével, amelyet korábban a hippokampusz képalkotására is alkalmaztak (Horton et al., 2013; Ouzounov et al., 2017). A háromfotonos mikroszkópia lényegesen nagyobb jel-háttér arányt ad, mint a kétfotonos mikroszkópia, ezért mélyebb szöveti struktúrák leképezésére is használható.
Ez különösen fontos, hogy ne csak a különböző CNS-régiókat, hanem az ezeken belüli különböző neuronokat is figyelembe vegyük. Korábbi kutatások arra utalnak, hogy mechanisztikus különbségek vannak abban, hogy a különböző neuron altípusok hogyan szabályozzák a mielinációt (Koudelka és mtsai., 2016). Emellett a mielin lokális szabályozásában is lehet sokféleség. Lényeges megjegyezni, hogy a CNS különböző részei nem különálló entitások, hanem összekapcsolódnak. A mezoszintű konnektomika integrálása, amely a különböző neuron altípusok különböző régiók közötti kapcsolatainak megértésére összpontosít (Zeng, 2018), kulcsfontosságú lesz annak megértéséhez, hogy hogyan változik az élethosszig tartó myelinizáció dinamikája a különböző áramkörök között.
Mi a funkcionális következménye a myelin szabályozásának a különböző áramkörök mentén? A funkcionális következményekre eddig csak a viselkedéssel való összefüggésekből lehetett következtetni. Végső soron szükség van a mielin dinamika mérésének összekapcsolására az áramkörök aktivitásának közvetlen értékelésével. Ehhez a neuronális aktivitás rögzítésére lesz szükség a mielinizáció longitudinális vizsgálatai során, hogy a megfigyelt de novo mielinizációt vagy a burkolat átalakulását közvetlenül össze lehessen kapcsolni az áramkörök működésében idővel bekövetkező változásokkal. Fontos lesz az egyes neuronok és axonok myelin dinamikájának és elektrofiziológiai aktivitásának mérése annak meghatározása érdekében, hogy a különböző myelinhüvely-paraméterekben bekövetkező változások hogyan befolyásolják a vezetési tulajdonságokat az egyes sejtek szintjén, valamint az aktivitás értékelése populációs szinten. Az olyan eszközök, mint a genetikailag kódolt Ca2+ vagy feszültségindikátorok lehetővé teszik az áramköri aktivitás viszonylag non-invazív rögzítését, és akár az egész agyi áramkörök aktivitásának értékelésére is felhasználhatók (Ahrens és mtsai., 2012; Lovett-Barron és mtsai., 2017).
Következtetés
Az axonok myelinizációja erőteljes potenciális mechanizmust jelent az áramköri működés szabályozására az élet során. A kutatások kimutatták, hogy a de novo myelinizáció az agykéregben (új oligodendrociták termelődésén keresztül) még felnőttkorban is előfordul, és hogy ez fokozható az áramköri aktivitás serkentésével. Ha egyszer már kialakult a mielin, akkor az stabil, az oligodendrociták kevéssé cserélődnek, és a meglévő mielinhüvelyek hossza csak korlátozottan változik. Ezek a stabil struktúrák azonban megtarthatják az átalakulás képességét, ha a mielint megzavarják. Ez érdekes következményekkel jár a mielin plaszticitását illetően az áramkörök működésének fenntartásában sérülés, betegség és idős kor során. Azt, hogy a myelinizációban bekövetkező változások pontosan hogyan befolyásolják a mögöttes áramkör működését, még nem tudjuk. Végső soron egy áramköri szintű megközelítésre van szükség, amely integrálja a mielin dinamikájának elemzését az áramkör funkciójának közvetlen mérésével, hogy teljes mértékben értékelni tudjuk, hogyan befolyásolja a dinamikus mielinizáció a teljes idegrendszer működését az élet során.
A szerzők hozzájárulása
A felsorolt szerzők mindegyike jelentősen, közvetlenül és intellektuálisan hozzájárult a munkához, és jóváhagyta annak közzétételét.
Finanszírozás
A DAL-t a Wellcome Trust Senior Research Fellowship (102836/Z/13/Z) támogatta. JMW-t az Edinburgh-i Egyetem Ph.D. Tissue Repair Studentship Award (MRC Doctoral Training Partnership MR/K501293/1) és a Wellcome Trust Four-Year Ph.D. Program in Tissue Repair (Grant 108906/Z/15/Z) támogatja.
Conflict of Interest Statement
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Ahrens, M. B., Li, J. M., Orger, M. B., Robson, D. N., Schier, A. F., Engert, F., et al. (2012). Agyi szintű neuronális dinamika a motoros adaptáció során zebrahalakban. Nature 485, 471-477. doi: 10.1038/nature11057
PubMed Abstract | CrossRef Full Text | Google Scholar
Almeida, R. G., and Lyons, D. A. (2017). A myelinizált axonok plaszticitásáról és a neuronális áramkörök kialakulásáról és működéséről. J. Neurosci. 37, 10023-10034. doi: 10.1523/JNEUROSCI.3185-16.2017
CrossRef Full Text | Google Scholar
Arancibia-Cárcamo, I. L., Ford, M. C., Cossell, L., Ishida, K., Tohyama, K., and Attwell, D. (2017). Node of Ranvier length as a potential regulator of myelinated axon conduction speed. eLife 6:e23329. doi: 10.7554/eLife.23329
PubMed Abstract | CrossRef Full Text | Google Scholar
Auer, F., Vagionitis, S., and Czopka, T. (2018). A myelinhüvely átalakulásának bizonyítékai a CNS-ben in vivo képalkotással feltárva. Curr. Biol. 28, 549-559. doi: 10.1016/j.cub.2018.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Barres, B. A., Hart, I. K., Coles, H. S. R., Burne, J. F., Voyvodic, J. T., Richardson, W. D., et al. (1992). Sejtpusztulás és a sejtek túlélésének szabályozása az oligodendrocita vonalban. Cell 70, 31-46. doi: 10.1016/0092-8674(92)90531-G
CrossRef Full Text | Google Scholar
Bechler, M. E., Byrne, L., and Ffrench-Constant, C. (2015). A CNS myelinhüvely hossza az oligodendrociták belső tulajdonsága. Curr. Biol. 25, 2411-2416. doi: 10.1016/j.cub.2015.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, A., Nishiyama, A., Peterson, J., Prineas, J., and Trapp, B. D. (2000). NG2-pozitív oligodendrocita progenitor sejtek felnőtt emberi agyban és sclerosis multiplex elváltozásokban. J. Neurosci. 20, 6404-6412. doi: 10.1523/JNEUROSCI.20-17-06404.2000
PubMed Abstract | CrossRef Full Text | Google Scholar
Cox, S. R., Ritchie, S. J., Tucker-Drob, E. M., Liewald, D. C., Hagenaars, S. P., Davies, G., et al. (2016). Az öregedés és az agy fehérállományának szerkezete 3513 UK Biobank résztvevőnél. Nat. Commun. 7:13629. doi: 10.1038/ncomms13629
PubMed Abstract | CrossRef Full Text | Google Scholar
Czopka, T., Ffrench-Constant, C., and Lyons, D. A. (2013). Az egyes oligodendrocitáknak csak néhány órájuk van arra, hogy új mielinhüvelyeket hozzanak létre in vivo. Dev. Cell 25, 599-609. doi: 10.1016/j.devcel.2013.05.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Dawson, M. R. L., Polito, A., Levine, J. M., and Reynolds, R. (2003). NG2-expresszáló gliális progenitor sejtek: a ciklikus sejtek bőséges és széles körben elterjedt populációja a felnőtt patkány CNS-ben. Mol. Cell. Neurosci. 24, 476-488. doi: 10.1016/S1044-7431(03)00210-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Fard, M. K., Van der Meer, F., Sánchez, P., Cantuti-Castelvetri, L., Mandad, S., Jäkel, S., et al. (2017). A BCAS1 expressziója meghatározza a korai myelinizáló oligodendrociták populációját a szklerózis multiplex léziókban. Sci. Transl. Med. 9:eaam7816. doi: 10.1126/scitranslmed.aam7816
PubMed Abstract | CrossRef Full Text | Google Scholar
Fields, R. D. (2015). Az idegrendszeri plaszticitás új mechanizmusa: aktivitásfüggő myelinizáció. Nat. Rev. Neurosci. 16, 756-767. doi: 10.1038/nrn4023
PubMed Abstract | CrossRef Full Text | Google Scholar
Ford, M. C., Alexandrova, O., Cossell, L., Stange-Marten, A., Sinclair, J., Kopp-Scheinpflug, C., et al. (2015). A Ranvier-csomópont és az internodium tulajdonságainak hangolása myelinizált axonokban az akciós potenciálok időzítésének beállításához. Nat. Commun. 6:8073. doi: 10.1038/ncomms9073
PubMed Abstract | CrossRef Full Text | Google Scholar
Gibson, E. M., Purger, D., Mount, C. W., Goldstein, A. K., Lin, G. L., Wood, L. S., et al. (2014). A neuronális aktivitás elősegíti az oligodendrogenezist és az adaptív myelinizációt az emlősök agyában. Science 344:1252304. doi: 10.1126/science.1252304
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Li, A. M., and Grutzendler, J. (2018). Élethosszig tartó kortikális mielin-plaszticitás és az életkorral összefüggő degeneráció élő emlősök agyában. Nat. Neurosci. 21, 683-695. doi: 10.1038/s41593-018-0120-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Patel, K. D., Goncalves, C. M., Grutzendler, J., and Nishiyama, A. (2014). Az oligodendrociták generációjának modulációja egy kritikus időbeli ablakban az NG2 sejtosztódás után. Nat. Neurosci. 17, 1518-1527. doi: 10.1038/nn.3815
PubMed Abstract | CrossRef Full Text | Google Scholar
Horton, N. G., Wang, K., Kobat, D., Clark, C. G., Wise, F. W., Schaffer, C. B., et al. (2013). A szubkortikális struktúrák in vivo háromfoton-mikroszkópos vizsgálata intakt egéragyban. Nat. Photonics 7, 205-209. doi: 10.1038/NPHOTON.2012.336
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, B., Wei, W., Wang, G., Gaertig, M. A., Feng, Y., Wang, W., et al. (2015). A mutáns huntingtin lefelé szabályozza a myelin szabályozó faktor által közvetített myelin gén expresszióját és befolyásolja az érett oligodendrocitákat. Neuron 85, 1212-1226. doi: 10.1016/j.neuron.2015.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Kang, S. H., Fukaya, M., and Bergles, D. E. (2013). Az oligodendrocita progenitorok egyensúlyt tartanak a növekedés és az önvisszaszorítás között a homeosztázis elérése érdekében a felnőtt agyban. Nat. Neurosci. 16, 668-676. doi: 10.1038/nn.3390
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., and Bergles, D. E. (2018). Myelin remodelling a tapasztalatfüggő oligodendrogenezis révén a felnőtt szomatoszenzoros kéregben. Nat. Neurosci. 21, 696-706. doi: 10.1038/s41593-018-0121-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Jung, J. C., Mehta, A. D., Aksay, E., Stepnoski, R., and Schnitzer, M. J. (2004). In vivo emlősök agyának képalkotása egy- és kétfotonos fluoreszcens mikroendoszkópiával. J. Neurophysiol. 92, 3121-3133. doi: 10.1152/jn.00234.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kang, S. H., Li, Y., Fukaya, M., Lorenzini, I., Cleveland, D. W., Ostrow, L. W., et al. (2013). A szürkeállomány oligodendrocitáinak degenerációja és károsodott regenerációja amyotrófiás laterálszklerózisban. Nat. Neurosci. 16, 571-579. doi: 10.1038/nn.3357
PubMed Abstract | CrossRef Full Text | Google Scholar
Koudelka, S., Voas, M. G., Almeida, R. G., Baraban, M., Soetaert, J., Meyer, M. P., et al. (2016). Az egyes neuronális altípusok sokféleséget mutatnak a szinaptikus vezikulák felszabadulása által közvetített CNS myelinizációban. Curr. Biol. 26, 1447-1455. doi: 10.1016/j.cub.2016.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Kougioumtzidou, E., Shimizu, T., Hamilton, N. B., Tohyama, K., Sprengel, R., Monyer, H., et al. (2017). Az oligodendrocita prekurzorok AMPA-receptorokon keresztüli jelátvitel elősegíti a mielinációt az oligodendrocita túlélés fokozásával. eLife 6:e28080. doi: 10.7554/eLife.28080
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, J., Kim, M., Park, H., Kang, B.-M., Jo, Y., Kim, J.-H., et al. (2017). Címke nélküli nanoszintű optikai mérés myelinizált axonokon in vivo. Nat. Commun. 8:1832. doi: 10.1038/s41467-017-01979-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., and Webb, W. W. (2004). Mély agyszövetek in vivo multifoton mikroszkópiája. J. Neurophysiol. 91, 1908-1912. doi: 10.1152/jn.01007.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lim, H., Sharoukhov, D., Kassim, I., Zhang, Y., Salzer, J. L., and Melendez-Vasquez, C. V. (2014). A Schwann-sejtek myelinizációjának jelölésmentes képalkotása harmadik harmonikus generációs mikroszkópiával. Proc. Natl. Acad. Sci. U.S.A. 111, 18025-18030. doi: 10.1073/pnas.1417820111
PubMed Abstract | CrossRef Full Text | Google Scholar
Locatelli, G., Theodorou, D., Kendirli, A., Jordão, M. J. C., Staszewski, O., Phulphagar, K., et al. (2018). A mononukleáris fagociták lokálisan specifikálják és adaptálják fenotípusukat egy szklerózis multiplex modellben. Nat. Neurosci. 21, 1196-1208. doi: 10.1038/s41593-018-0212-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett-Barron, M., Andalman, A. S., Allen, W. E., Vesuna, S., Kauvar, I., Burns, V. M., et al. (2017). Az agyi állapot koordinált modulációjának ősi áramkörei. Cell 171, 1411-1423. doi: 10.1016/j.cell.2017.10.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Mabbott, D. J., Noseworthy, M., Bouffet, E., Laughlin, S., and Rockel, C. (2006). A fehérállomány növekedése mint a kognitív fejlődés mechanizmusa gyermekeknél. Neuroimage 33, 936-946. doi: 10.1016/j.neuroimage.2006.07.024
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenzie, I. A., Ohayon, D., Li, H., Paes de Faria, J., Emery, B., Tohyama, K., et al. (2014). A motoros készségek tanulása aktív központi myelinizációt igényel. Science 346, 318-322. doi: 10.1126/science.1254960
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitew, S., Gobius, I., Fenlon, L. R., McDougall, S. J., Hawkes, D., Xing, Y. L., et al. (2018). A neuronális aktivitás farmakogenetikai stimulálása axon-specifikus módon növeli a mielinációt. Nat. Commun. 9:306. doi: 10.1038/s41467-017-02719-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mount, C. W., and Monje, M. (2017). Becsomagolva az alkalmazkodáshoz: tapasztalatfüggő myelinizáció. Neuron 95, 743-756. doi: 10.1016/j.neuron.2017.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Ouzounov, D. G., Wang, T., Wang, M., Feng, D. D., Horton, N. G., Cruz-Hernández, J. C., et al. (2017). In vivo háromfotonos képalkotás a GCaMP6-jelölt neuronok aktivitásának mélyen az ép egéragyban. Nat. Methods 14, 388-390. doi: 10.1038/nmeth.4183
PubMed Abstract | CrossRef Full Text | Google Scholar
Ritchie, S. J., Bastin, M. E., Tucker-Drob, E. M., Maniega, S. M., Engelhardt, L. E., Cox, S. R., et al. (2015). Az agyi fehérállomány mikrostruktúrájának és a folyékony intelligenciának a későbbi életkorban bekövetkező kapcsolt változásai. J. Neurosci. 35, 8672-8682. doi: 10.1523/JNEUROSCI.0862-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Rivers, L. E., Young, K. M., Rizzi, M., Jamen, F., Psachoulia, K., Wade, A., et al. (2008). A PDGFRA/NG2 glia myelinizáló oligodendrocitákat és piriform projekciós neuronokat hoz létre felnőtt egerekben. Nat. Neurosci. 11, 1392-1401. doi: 10.1038/nn.2220
PubMed Abstract | CrossRef Full Text | Google Scholar
Sampaio-Baptista, C., Khrapitchev, A. A., Foxley, S., Schlagheck, T., Scholz, J., Jbabdi, S., et al. (2013). A motoros készségek tanulása változásokat indukál a fehérállomány mikrostruktúrájában és a mielinizációban. J. Neurosci. 33, 19499-19503. doi: 10.1523/jneurosci.3048-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Scantlebury, N., Cunningham, T., Dockstader, C., Laughlin, S., Gaetz, W., Rockel, C., et al. (2014). A fehérállomány érése és a reakcióidő közötti kapcsolatok gyermekkorban. J. Int. Neurophsychol. Soc. 20, 99-112. doi: 10.1017/S1355617713001148
PubMed Abstract | CrossRef Full Text | Google Scholar
Schain, A. J., Hill, R. A., and Grutzendler, J. (2014). A myelinizált axonok címkézésmentes in vivo képalkotása egészségben és betegségben spektrális konfokális reflexiós mikroszkópiával. Nat. Med. 20, 443-449. doi: 10.1038/nm.3495
PubMed Abstract | CrossRef Full Text | Google Scholar
Scholz, J., Klein, M. C., Behrens, T. E. J., and Johansen-berg, H. (2009). Az edzés változásokat indukál a fehérállomány architektúrájában. Nat. Neurosci. 12, 1370-1371. doi: 10.1038/nn.2412
PubMed Abstract | CrossRef Full Text | Google Scholar
Snaidero, N., Möbius, W., Czopka, T., Hekking, L. H. P., Mathisen, C., Verkleij, D., et al. (2014). A CNS-axonok mielinmembránba burkolása PI(3,4,5,5)P3-függő polarizált növekedéssel a belső nyelvnél. Cell 156, 277-290. doi: 10.1016/j.cell.2013.11.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Takahashi, N., Sakurai, T., Davis, K. L., and Buxbaum, J. D. (2011). Az oligodendrociták és a mielin diszfunkciójának összekapcsolása a neurocirkuláris rendellenességekkel a skizofréniában. Prog. Neurobiol. 93, 13-24. doi: 10.1016/j.pneurobio.2010.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tomassy, G. S., Berger, D. R., Chen, H.-H., Kasthuri, N., Hayworth, K. J., Vercelli, A., et al. (2014). A neokortexben lévő piramidális neuronok egyes axonjai mentén a mielin eloszlásának megkülönböztetett profiljai. Science 344, 319-324. doi: 10.1126/science.1249766
PubMed Abstract | CrossRef Full Text | Google Scholar
Tripathi, R. B., Jackiewicz, M., Mckenzie, I. A., Kougioumtzidou, E., Grist, M., and Richardson, W. D. (2017). A myelinizáló oligodendrociták figyelemre méltó stabilitása egerekben. Cell Rep. 21, 316-323. doi: 10.1016/j.celrep.2017.09.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Viganò, F., Möbius, W., Götz, M., and Dimou, L. (2013). A transzplantáció regionális különbségeket mutat az oligodendrociták differenciálódásában a felnőtt agyban. Nat. Neurosci. 16, 1370-1372. doi: 10.1038/nn.3503
PubMed Abstract | CrossRef Full Text | Google Scholar
Watkins, T. A., Emery, B., Mulinyawe, S., and Barres, B. A. (2008). A myelinizáció gamma-szekretáz és asztrociták által szabályozott, elkülönülő szakaszai egy gyorsan myelinizáló CNS-kokultúrás rendszerben. Neuron 60, 555-569. doi: 10.1016/j.neuron.2008.09.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Waxman, S. G. (1980). A vezetési sebesség meghatározói myelinizált idegrostokban. Muscle Nerve 3, 141-150. doi: 10.1002/mus.880030207
PubMed Abstract | CrossRef Full Text | Google Scholar
Xiao, L., Ohayon, D., Mckenzie, I. A., Sinclair-Wilson, A., Wright, J. L., Fudge, A. D., et al. (2016). Az új oligodendrociták gyors termelődése szükséges a motoros készségek tanulásának legkorábbi szakaszában. Nat. Neurosci. 19, 1210-1217. doi: 10.1038/nn.4351
PubMed Abstract | CrossRef Full Text | Google Scholar
Yeung, M. S. Y., Zdunek, S., Bergmann, O., Bernard, S., Salehpour, M., Alkass, K., et al. (2014). Az oligodendrocita generáció és a myelinizáció dinamikája az emberi agyban. Cell 159, 766-774. doi: 10.1016/j.cell.2014.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Young, K. M., Psachoulia, K., Tripathi, R. B., Dunn, S.-J., Cossell, L., Attwell, D., et al. (2013). Oligodendrociták dinamikája az egészséges felnőttkori CNS-ben: bizonyítékok a mielin átalakítására. Neuron 77, 873-885. doi: 10.1016/j.neuron.2013.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, H. (2018). Mezoszintű konnektomika. Curr. Opin. Neurobiol. 50, 154-162. doi: 10.1016/j.conb.2018.03.003
PubMed Abstract | CrossRef Full Text | Google Scholar