Aspartate Aminotransferaseby Luke Spooner
Contents
- 1 Function
- 2 Structure
- 3 Funkció
- 4 Klinikai alkalmazások
- 5 Aszpartát-aminotranszferáz 3D szerkezete
Funkció
Aszpartát-aminotranszferáz (AAT), más néven glutamino-aszparaginsav-transzamináz, glutamino-oxálecetsav-transzamináz, prefenát-aminotranszferáz és transzamináz A egy enzim, amely az I. osztályú piridoxál-foszfát-függő aminotranszferáz család tagja . A GOT1 gén kódolja. Ez egy 413 aminosav hosszúságú homodimer, amely kritikus szerepet tölt be az aminosav- és szénhidrát-anyagcserében, az ureogenezisben, valamint a redukáló ekvivalensek mitokondriumba és kloroplasztiszba történő átvitelében. A prokarióta sejteken belül kizárólag a citoszolban található, de eukarióta sejtekben citoszol, mitokondrium és kloroplasztisz izoenzimjei is vannak. A bifunkcionális aszpartát-aminotranszferáz (BAAT) szükséges a prefanát arogenáttá történő transzaminálásához.
Az emberi szervezetben az agyban, a vázizmokban, a májban, a hasnyálmirigyben, a vörösvértestekben és a vesében termelődik . A szövetek széles köre, amelyekben termelődik, elválasztja a hasonló enzimtől, az alanin-transzamináztól (ALT), amely elsősorban a májban található. Az AAT szintje a szervezetben a szöveti betegségek vagy károsodások markereként használható. Valamint az AAT és az ALT szintjét össze lehet hasonlítani annak megállapítására, hogy a szöveti károsodás elsősorban a májban található-e.
Szerkezet
, amely (alfa hélixeket, béta szálakat , hurkokat , fordulatokat) tartalmaz. Aszpartát aminotranszferáz aszimmetrikus egysége, kiemelt kis és nagy doménnel és PLP kofaktorral (1b4x). Mindegyik alegység egy-egy egyenértékű aktív centrumot tartalmaz. Az alegységek két helyen kapcsolódnak: a nagy doménjeik között és az N-terminális maradékok és a másik alegység nagy doménje között. Az AST-nek ez a szerkezete az E. coli-tól az emberig apró eltéréseket mutat az egyes organizmusok között. Az aktív centrum szerkezete is erősen konzervált, 25%-os szekvencia-homológiával.
A homodimer minden alegysége tovább oszlik egy kis és egy nagy doménre. Az N-terminustól a Pro 48 maradékig és a Met 326-tól a C-terminusig terjedő aminosavakból áll. A fennmaradó aminosavak alkotják a , és a , amelyeket egy 32 aminosavból álló hosszú α-hélix köt össze.
A nagy doménben található az AAT aktív centruma, és ennek befogadására a mag számos α/β szuperszekunder szerkezetet tartalmaz. Ezzel szemben a kis alegység magja két α-hélixből és két β-szálból áll. A többsejtű szervezetekben a 325. maradéknál van egy csomópont, amely a kis domén csuklójaként működik, ami lehetővé teszi az ebből eredő konformációs változásokat, amelyek az inhibitorok enzimhez való kötődésekor következnek be.
Amint fentebb említettük, az AST aktív centruma az alegység nagy doménjén helyezkedik el. Az aktív centrumon belül található a Lys 258 aminómaradék, más néven belső aldimin, amely a kofaktor piridoxal 5′-foszfáttal () kötődik, egy úgynevezett Schiff-bázist alkotva. Egy aminosav-szubsztrát hozzáadásakor a PLP és az aminosav között új Schiiff-bázis képződik.
Funkció
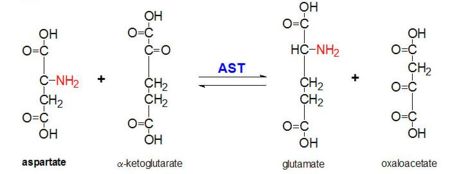
2. ábra: L-aszpartát és α-ketoglutarát transzaminációs reakciója, melyet az aszpartát-aminotranszferáz katalizál
AAT katalizálja az L-aszpartát α-aminocsoportjának reverzibilis transzaminációját α-ketoglutarátra, oxalacetátot és glutamátot képezve. Ez a reaktivitás E.coliban alacsonyabb, mint a magasabb eukariótákban, és szélesebb szubsztrátspecifitással rendelkezik. A reakció azonban ugyanúgy zajlik. Egy aminosav-szubsztrát bevezetésekor egy új Schiff-bázis képződik közte és a PLP kofaktor között. Ennek hatására az aminosav elveszít egy hidrogént, és egy kinozid intermedier képződik, és a reprotanáció során egy ketimin keletkezik. Ezután a szerkezet hidrolizálódik, α-ketosavat és piridoxamin-foszfátot képezve. A 2-metil-aszpartát akkor hat az AAT gátlójaként, ha nem aszpartát, hanem Schiif-bázist képez a PLP kofaktorral. Ez azt eredményezi, hogy a folyamat megáll az alfa-fehérje eliminációját megelőző lépésnél.
Ez a reakció elengedhetetlen a szervezet homeosztázisának fenntartásához. A négy különböző molekula, amely ennek a transzanimációnak az eredményeként képződhet (oxalacetát, α-ketoglutarát, aszpartát, L-glutamát), számos anyagcsere-folyamat szempontjából kritikus fontosságú. Az oxalacetát és az α-ketoglutarát kritikus szerepet játszik a Krebs-ciklusban, az aszpartát különböző formái fontos molekulák a karbamidciklusban és részt vesznek a glükoneogenezisben, a glutamát pedig fontos molekula a memóriával kapcsolatos metabolikus útvonalakban.
Klinikai alkalmazások
Az AAT szintje a szervezetben szöveti károsodást és betegséget jelez. Normális esetben az AAT minimális mennyiségben található meg a vérben, azonban a fent említett szervek károsodásakor az AAT a vérbe kerül. A felszabaduló mennyiség arányos az elszenvedett károsodás mértékével. Kimutatták, hogy az AAT szintje a kezdeti szöveti károsodást követő 6 órán belül jelentősen emelkedik, és akár 4 napig is emelkedett maradhat. Az AAT-szinteket más enzimek szintjével összehasonlítva az orvosok felhasználhatják annak meghatározására, hogy a szervezetben hol történt a károsodás. Az ALT-vel való összehasonlítás különösen hasznosnak bizonyult a májkárosodás, például a májzsugor és a májgyulladás azonosításában. Normális körülmények között az AAT szintje férfiaknál 6-34 IU/L, nőknél pedig 8-40 IU/L.
Az aszpartát-aminotranszferáz 3D struktúrái
Aszpartát-aminotranszferáz 3D struktúrái
.