A sók általános tulajdonságai
A sók néhány jellemző tulajdonsága:
- Olvadás- és forráspont: A sók többnyire szilárd anyagok, amelyek magas hőmérsékleten olvadnak és forrnak is.
- Vízben való oldhatóság: A sók általában vízben oldódnak. Például a nátrium-klorid, kálium-szulfát, alumínium-nitrát, ammónium-karbonát stb. oldható sók, míg az ezüst-klorid, ólom-klorid, réz-karbonát stb. vízben nem oldódik.
- Kristályosodási víz: A sók általában olyan kristályok formájában találhatók meg, amelyekben vízmolekulák vannak jelen. Ezt a vizet kristályvíznek nevezzük, és az ilyen sókat hidratált sóknak nevezzük.
Például a réz-szulfátkristályban minden egyes réz-szulfátmolekulára öt vízmolekula jut. Ezt CuSO4.5H2O-ként írjuk le. Ez a kristályvíz adja a kristály alakját. Egyes kristályoknak színt is ad. Melegítéskor a hidratált sók elveszítik kristályvizüket, és ennek következtében a kristályok elveszítik alakjukat és színüket, és porszerű anyaggá alakulnak.
A kristályvizüket elvesztett hidratált sókat vízmentes sóknak nevezzük.
A hidratált réz-szulfát melegítéskor vízmolekulákat ad le, és fehér porszerű vízmentes réz-szulfátot képez. Víz hozzáadásával ez az anyag ismét hidratált réz-szulfátoldattá alakulhat vissza.
Az emberek azt is kérdezik
- A sók osztályozása
- A különböző sók felhasználása a mindennapi életben
- A sók előállítása
- Az oldható és oldhatatlan sók előállításának leírása
- Kv. Sók analízise
- Hőhatás a sókra
- Kationok és anionok vizsgálata vizes oldatokban
- Ionegyenletek felállítása a folyamatos variáció módszerével
- Mi a sztöchiometria és miért használják a kémiában?
A sók általános tulajdonságai :
1. Reakció savval : Amikor egy só reakcióba lép egy savval, egy másik só és sav keletkezik. Például, ha nátrium-kloridot kénsavval hevítünk, nátrium-hidrogén-szulfát (alacsony hőmérsékleten), majd nátrium-szulfát (magas hőmérsékleten) keletkezik, és hidrogén-klorid gáz keletkezik.
2. Reakció bázissal : Egy só reakcióba lép egy bázissal, és egy másik só és bázis keletkezik.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH
3. Reakció fémmel : Néha egy sóoldat reakcióba léphet egy fémmel. Ha például egy vasszöget rézszulfát vizes oldatába mártunk, a réz lerakódik a szög felületén, a keletkezett vasszulfát pedig az oldatban marad.
CuSO4 + Fe → FeSO4 + Cu
Ez a reakció azt mutatja, hogy a vas reakcióképesebb, mint a réz.
Így a reaktívabb fém kiszoríthat egy kevésbé reaktív fémet a sójának oldatából.
4. A sók viselkedése a vízzel szemben :
Amikor egy só vízben oldódik, az oldat lehet semleges, savas vagy lúgos. Ez a só természetétől függ.
(i) Egy erős savból és egy erős bázisból származó normál só semleges oldatot ad. Például a NaCl és a K2SO4 vizes oldatai lakmuszhoz semlegesek.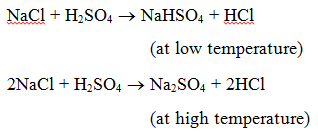
(ii) Egy gyenge savból és egy erős bázisból származó normál só lúgos oldatot ad. Például mind a nátrium-karbonát (Na2CO3), mind a nátrium-acetát (CH3COONa) vizes oldata lúgos.
Na2CO3 + 2H2O → 2NaOH + CO2 + H2O
CH3COONa + H2O → CH3COOH + NaOH
(iii) Egy erős savból és egy gyenge bázisból származó só savas oldatot ad. Például mind az alumínium-klorid (AlCl3), mind az ammónium-klorid (NH4Cl) savas vizes oldatot ad.
AlCl3 + 3H2O → Al(OH)3 + 3HCl
NH4Cl + H2O → NH4OH + HCl
(iv) A savas sók oldatai lakmuszpapírra savasak, azaz ezek az oldatok a kék lakmuszpapírt vörösre színezik. Például a nátrium-hidrogén-szulfát (NaHSO4) oldata vörösre színezi a lakmuszpapírt.
A nátrium-hidrogénkarbonát (NaHCO3) oldata viszont enyhén lúgos
.