A kémiai reakciók ábrázolása
Ebben a fejezetben néhány olyan reakciót ismerünk meg, amelyekben a legfontosabb lépésekben egyetlen elektron mozgása történik. Talán emlékeznek még a 6.1A. fejezetből, hogy az egyes elektronok mozgását egy egyágú “halhorgos” nyíllal ábrázoljuk (szemben a jól ismert kétágú nyilakkal, amelyeket az egész könyvben a két elektron mozgásának ábrázolására használtunk).

Az egyelektronos mechanizmusok szabad gyökfajok, egy párosítatlan elektront tartalmazó, rendkívül instabil köztitermékek kialakulásával és az azt követő reakcióval járnak. Ebben a fejezetben megtanuljuk, hogy a szabad gyökök gyakran homolitikus hasadásból keletkeznek, olyan eseményből, amikor a felszakadó kovalens kötésben a két elektron ellentétes irányba mozog.

(Ezzel szemben lényegében az összes eddig tanult reakcióban olyan kötéstörési események történnek, amelyekben mindkét elektron azonos irányba mozog: ezt heterolitikus hasadásnak nevezzük).
Azt is meg fogjuk tanulni, hogy sok egyelektronos mechanizmus gyökös láncreakció formájában zajlik, amelyben egy gyök egy második gyök képződését okozza, amely viszont egy harmadik gyök képződését okozza, és így tovább.
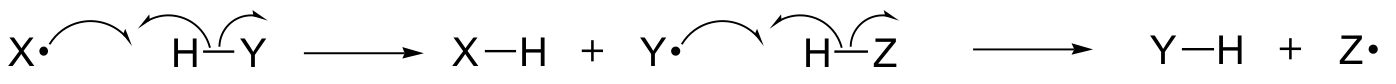
A szabad gyökfajok nagy reakcióképessége és láncreakciók indítására való képességük gyakran előnyös – ebben a fejezetben meg fogjuk ismerni a gyökös polimerizációs reakciókat, amelyekből olyan hasznos anyagok keletkeznek, mint a plexiüveg és a polipropilén szövet. Tanulni fogunk olyan gyökös reakciókról is, amelyek károsak, például a légköri ózon freon általi lebontásáról, valamint a szabad gyökfajok által a testünkben lévő lipidekben és DNS-ben okozott oxidatív károkról. Végül látni fogjuk, hogy egyes enzimek hogyan használják a kötött fémeket a magas e
A széngyökök geometriája és relatív stabilitása
Szerves kémikusokként különösen érdekelnek bennünket azok a radikális köztitermékek, amelyekben a párosítatlan elektron egy szénatomon tartózkodik. Kísérleti bizonyítékok azt mutatják, hogy a széngyökben lévő három kötés trigonális síkbeli geometriájú, ezért a szenet sp2-hibridizáltnak tekintjük, ahol a párosítatlan elektron a merőleges, nem hibridizált 2pzorbitált foglalja el. Állítsuk szembe ezt a képet a karbokation és a karbanion intermedierekkel, amelyek szintén trigonális síkúak, de 2pz-orbitáljaik nulla, illetve két elektront tartalmaznak.

A széngyökök stabilitásának tendenciája párhuzamos a karbokationokéval (8.4B szakasz): a tercier gyökök például stabilabbak a szekunder gyököknél, majd a primer és a metilgyökök következnek. Ennek intuitív értelme van, mivel a gyökök, akárcsak a karbokationok, elektronhiányosnak tekinthetők, és így a közeli alkilcsoportok elektron-leadó hatása stabilizálja őket. A benzil- és allilgyökök a rezonanciahatások miatt stabilabbak, mint az alkilgyökök – egy párosítatlan elektron delokalizálható a konjugált pi-kötések rendszerén keresztül. Az allilgyök például úgy képzelhető el, mint három párhuzamos, három elektronon osztozó 2pz pálya rendszere.
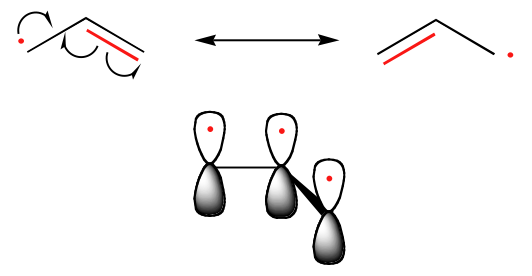
Tendenciák a gyökök stabilitásában
Allikus & Benzil > 3o > 2o > 1o > Metil

Ebben a molekulában az amúgy is kiterjedt rezonancia-stabilizációt tovább fokozza a klóratomok azon képessége, hogy a gyökcentrumot megvédik a külső reagensektől. A gyök bizonyos értelemben egy védő “ketrecben” van.
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)
-
Prof. Steven Farmer (Sonoma State University)
- Layne A. Morsch (University of Illinois Springfield)