Suolojen yleiset ominaisuudet
Joitakin suolojen tyypillisiä ominaisuuksia ovat:
- Sulamis- ja kiehumispisteet: Suolat ovat enimmäkseen kiinteitä aineita, jotka sekä sulavat että kiehuvat korkeissa lämpötiloissa.
- Liukoisuus veteen: Suolat liukenevat yleensä veteen. Esimerkiksi natriumkloridi, kaliumsulfaatti, alumiininitraatti, ammoniumkarbonaatti jne. ovat liukoisia suoloja, kun taas hopeakloridi, lyijykloridi, kuparikarbonaatti jne. ovat veteen liukenemattomia.
- Kiteytysvesi: Yleensä suolat esiintyvät kiteinä, joissa on vesimolekyylejä. Tätä vettä kutsutaan kiteytymisvedeksi ja tällaisia suoloja kutsutaan hydratoiduiksi suoloiksi.
Esimerkiksi kuparisulfaattikiteessä on viisi vesimolekyyliä kutakin kuparisulfaattimolekyyliä kohti. Tämä kirjoitetaan muodossa CuSO4.5H2O. Tämä kiteytymisvesi antaa kiteelle sen muodon. Se antaa myös joillekin kiteille värin. Kuumennettaessa hydratoidut suolat menettävät kiteytymisvetensä, minkä seurauksena kiteet menettävät muotonsa ja värinsä ja muuttuvat jauhemaiseksi aineeksi.
Kiteytymisvetensä menettäneitä hydratoituja suoloja kutsutaan vedettömiksi suoloiksi.
Kun hydratoitua kuparisulfaattia kuumennetaan, se luovuttaa vesimolekyylejä muodostaen valkoista jauhemaista vedetöntä kuparisulfaattia. Kun vettä lisätään, tämä aine voi muuttua takaisin hydratoiduksi kuparisulfaattiliuokseksi.
Kysytään myös
- Suolojen luokittelu
- Erilaisten suolojen käyttötarkoitukset jokapäiväisessä elämässä
- Suolojen valmistus
- Kuvaa liukenevien ja liukenemattomien suolojen valmistusta
- Kuvaa liukenevien ja liukenemattomien suolojen valmistusta
- Qualitative Suolojen analysointi
- Lämmön vaikutus suoloihin
- Kationien ja anionien määrittäminen vesiliuoksissa
- Ioniyhtälöiden muodostaminen jatkuvan vaihtelun menetelmällä
- Mitä on stoikiometria ja miksi sitä käytetään kemiassa?
Suolojen yleiset ominaisuudet :
1. Reaktio hapon kanssa : Kun suola reagoi hapon kanssa, muodostuu toinen suola ja happo. Esimerkiksi kun natriumkloridia kuumennetaan rikkihapon kanssa, syntyy ensin natriumhydrogensulfaattia (alhaisessa lämpötilassa) ja sitten natriumsulfaattia (korkeassa lämpötilassa) ja kehittyy kloorivetykaasua.
2. Reaktio emäksen kanssa : Suola reagoi emäksen kanssa tuottaen toisen suolan ja emäksen.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH
3. Reaktio metallin kanssa : Joskus suolaliuos voi reagoida metallin kanssa. Esimerkiksi kun rautanaula kastetaan kuparisulfaatin vesiliuokseen, kupari saostuu naulan pinnalle ja muodostunut rautasulfaatti jää liuokseen.
CuSO4 + Fe → FeSO4 + Cu
Tämä reaktio osoittaa, että rauta on kuparia reaktiivisempi.
Siten reaktiivisempi metalli voi syrjäyttää vähemmän reaktiivisen metallin sen suolan liuoksesta.
4. Suolojen käyttäytyminen suhteessa veteen :
Kun suola liuotetaan veteen, liuos voi olla neutraali, hapan tai emäksinen. Tämä riippuu käytetyn suolan luonteesta.
(i) Vahvasta haposta ja vahvasta emäksestä saatu tavallinen suola antaa neutraalin liuoksen. Esimerkiksi NaCl:n ja K2SO4:n vesiliuokset ovat lakmuksen kannalta neutraaleja.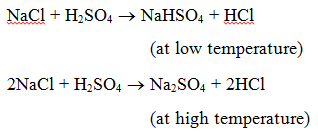
(ii) Tavallinen suola, joka on peräisin heikosta haposta ja vahvasta emäksestä, antaa emäksisen liuoksen. Esimerkiksi sekä natriumkarbonaatin (Na2CO3) että natriumasetaatin (CH3COONa) vesiliuokset ovat emäksisiä.
Na2CO3 + 2H2O → 2NaOH + CO2 + H2O
CH3COONa + H2O → CH3COOH + NaOH
(iii) Vahvasta haposta ja heikosta emäksestä johdettu suola antaa happaman liuoksen. Esimerkiksi sekä alumiinikloridi (AlCl3) että ammoniumkloridi (NH4Cl) muodostavat happamia vesiliuoksia.
AlCl3 + 3H2O → Al(OH)3 + 3HCl
NH4Cl + H2O → NH4OH + HCl
(iv) Happamien suolojen liuokset ovat lakmussuolan kannalta happamia eli nämä liuokset värjäävät sinisen lakmuspaperin punaiseksi. Esimerkiksi natriumhydrogensulfaatin (NaHSO4) liuos värjää lakmuspaperin siniseksi punaiseksi.
Natriumvetykarbonaatin (NaHCO3) liuos on kuitenkin lievästi emäksistä.