Tämä rakenne syntyy, kun polypeptidiketjun kaksi (tai useampi, esim. ψ-silmukka) segmenttiä limittyvät toisiinsa ja muodostavat rivin vetysidoksia keskenään. Tämä voi tapahtua yhdensuuntaisessa järjestelyssä:

tai antiparalleellisessa järjestelyssä:
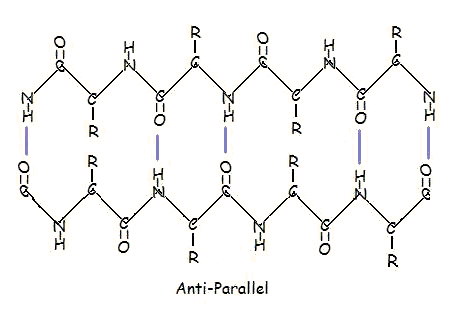
Paralleelinen ja antiparalleelinen järjestely on suora seuraus polypeptidiketjun suuntaisuudesta. Antiparalleellisessa järjestelyssä yhden segmentin C-terminaalinen pää on samalla puolella kuin toisen segmentin N-terminaalinen pää. Rinnakkaisessa järjestyksessä C-terminaalin pää ja N-terminaalin pää ovat molempien segmenttien samoilla puolilla. ”Pleissi” syntyy aminohappojen välisten peptidisidosten vuorottelevien tasojen vuoksi; kunkin vastakkaisen segmentin samansuuntaiset amino- ja karbonyyliryhmät vuorottelevat suuntautumistaan vastakkaisiin suuntiin toisiaan kohti osoittavista suunnista vastakkaisiin suuntiin osoittaviin suuntiin osoittaviin suuntiin.
Rinnakkainen järjestys ei ole yhtä vakaa, koska yksittäisten aminohappomolekyylien geometria pakottaa vetysidokset esiintymään vinossa, mikä tekee vetysidoksista pidempiä ja näin ollen heikompia. Sitä vastoin antiparalleellisessa järjestelyssä vetysidokset ovat suoraan vastakkain, mikä tekee sidoksista vahvempia ja vakaampia.
Tavanomaista on, että antiparalleelinen beetasolukko muodostuu, kun polypeptidiketjun suunta kääntyy jyrkästi. Tämä voi tapahtua, jos läsnä on kaksi peräkkäistä proliinijäännöstä, jotka luovat polypeptidiketjuun kulmikkaan mutkan ja taivuttavat sen takaisin itseensä. Tämä ei ole välttämätöntä, jotta polypeptidiketjun kauempana olevat segmentit muodostaisivat beetapliseerattuja arkkeja, mutta lähempänä oleville segmenteille se on ehdoton edellytys. Lyhyillä etäisyyksillä beetapliseeratun levyn kahta segmenttiä erottaa toisistaan 4+2n aminohappojäännöstä, joista 4 on vähimmäismäärä.