- Rikkitrioksidi Kemialliset ominaisuudet,käyttötarkoitukset,tuotanto
- Kemialliset ominaisuudet
- Fysikaaliset ominaisuudet
- Käyttötarkoitukset
- Tuotantomenetelmät
- Yleiskuvaus
- Aira & Vesi Reaktiot
- Reaktiivisuusprofiili
- Vaara
- Terveysvaara
- Palovaara
- Turvallisuusprofiili
- Potentiaalinen altistuminen
- varastointi
- Kuljetus
- Yhteensopimattomuudet
- Hävittäminen
Rikkitrioksidi Kemialliset ominaisuudet,käyttötarkoitukset,tuotanto
Kemialliset ominaisuudet
Rikkitrioksidi, S03, joka tunnetaan myös nimellä rikkihappoanhydridi, neulaset tai polymeeri, on olemassa useina modifikaatioina, jotka eroavat toisistaan molekyylilajeiltaan ja kiteiseltä muodoltaan. Sillä on valkoinen, jään kaltainen modifikaatio, joka sulaa 16 °C:ssa (61 °F), ja kaksi muuta bestosin kaltaista muotoa, jotka sulavat korkeammissa lämpötiloissa 33 ja 62 °C:ssa (90 ja 144 °F). Värittömässä neste- tai kaasumuodossa on ärsyttäviä, myrkyllisiä höyryjä, ja se kiehuu 45 °C:n (112 °F) lämpötilassa.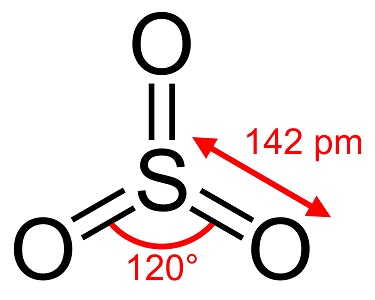
Rikkitrioksidi on erittäin reaktiivinen aine, voimakas hapetin ja palovaara. Se reagoi metallioksidien kanssa muodostaen sulfaatteja ja veden kanssa rikkihappoa. Rikkitrioksidia käytetään sulfonointiin.
Fysikaaliset ominaisuudet
Väritön neste huoneenlämmössä ja ilmanpaineessa; höyrystyy ilmassa.
Rikkitrioksidi pyrkii polymerisoitumaan, erityisesti jos läsnä on pieniä määriä vettä tai rikkihappoa. Sen polymeroitumisnopeus kuitenkin pieneneepaljon, kun sen jäätymispistettä lähestytään. Kiinteää (polymeeristä) rikkitrioksidia esiintyy kolmessa polymorfisessa faasissa: alfa-, beeta- ja gammamodifikaatioissa.
Alfa-faasi koostuu jään kaltaisista neulasista, joilla on polymeerinen ristisilloitettu rakenne. Se sulaa 62,3 °C:ssa ja sen höyrynpaine 25 °C:ssa on 73 torr.
Beta-faasi on metastabiili allotrooppi, jossa on valkoisia, asbestin kaltaisia, kiiltäviä neulasia, jotka koostuvat polymeerisistä molekyyleistä, se sulaa 32,5 °C:ssa ja sen höyrynpaine on 344 torr 25 °C:ssa.
Gammamodifikaatio voi tavanomaisissa lämpötiloissa esiintyä kiinteässä tai nestemäisessä muodossa. Kiinteässä muodossa se on kolloidisen jään kaltainen massa, joka sulaa 16,8 °C:ssa. Nestemäisessä muodossa sen tiheys on 1,9224 g/ml ja se kiehuu 44,8 °C:ssa. Sen höyrynpaine on 433 torr 25 °C:ssa. Gammafaasi koostuu sekä syklisistä trimeeri- että monomeerimolekyyleistä. Kun kiinteä rikkitrioksidi sulaa, se siirtyy gammafaasiinsa, joka jähmettyessään muuttuu alfamodifikaatioksi.
SO3:n kriittinen lämpötila on 217,8 °C; kriittinen paine 80,97 atm; kriittinen tiheys 0,63 g/cm3; nestemäisen SO3:n dielektrisyysvakio 18 °C:n lämpötilassa on 3,11.
Rikkitrioksidi liukenee veteen muodostaen rikkihappoa ja synnyttäen paljon lämpöä.
Käyttötarkoitukset
Rikkitrioksidia käytetään välituotteena rikkihapon ja oleumin valmistuksessa erityisesti väriaineiden ja väriaineiden sulfonointia varten sekä vedettömän typpihapon ja räjähteiden valmistuksessa. Kiinteää rikkitrioksidia pidetään kaupan esimerkiksi nimillä Sulphan ja Triosul, ja sitä käytetään pääasiassa orgaanisten happojen sulfonointiin. Rikkitetrafluoridi on fluorausaine. Rikkiheksafluoridi toimii kaasumaisena eristeenä korkeajännitteisissä sähkölaitteissa. Rikkifluoridia käytetään hyönteismyrkkynä ja kaasutusaineena.
Orgaanisten yhdisteiden, erityisesti ionittomien pesuaineiden, sulfonointi, aurinkoenergian keräimet. Sitä tuotetaan yleensä laitoksessa, jossa sitä käytetään.
Tuotantomenetelmät
Rikkitrioksidia tuotetaan välituotteena rikkihapon valmistuksessa kontaktimenetelmällä (ks. Rikkihappo). Prosessissa rikkidioksidi hapettuu katalyyttisesti trioksidiksi.
Rikkitrioksidia valmistetaan laboratoriossa kuumentamalla savuavaa rikkihappoa, tiivistämällä sen höyryt ja keräämällä ne viileään säiliöön. Kun höyryt lauhdutetaan alle 27 °C:n lämpötilaan hivenen kosteuden läsnä ollessa, syntyy kaikki kolme SO3:n polymorfista faasia. Ne voidaan erottaa toisistaan fraktioidulla tislauksella. Höyryjen kondensointi yli 27 °C:n lämpötilassa muodostaa gammarikkitrioksidin nestemäisen muunnoksen.
Yleiskuvaus
Rikkitrioksidi on värittömästä valkoiseen vaihteleva kiteinen kiinteä aine, joka haihtuu ilmassa. Toimitetaan usein inhibiittorin kanssa polymerisaation estämiseksi. Rikkitrioksidi reagoi voimakkaasti veden kanssa muodostaen rikkihappoa lämmön vapautuessa. Rikkitrioksidi syövyttää metalleja ja kudoksia. Rikkitrioksidi aiheuttaa silmä- ja ihopalovammoja. Nieleminen aiheuttaa vakavia palovammoja suussa ruokatorvessa ja vatsassa. Höyry on erittäin myrkyllistä hengitettynä. Rikkitrioksidi on palovaara joutuessaan kosketuksiin orgaanisten materiaalien, kuten puun, puuvillan, kuitulevyn jne. kanssa.
Aira & Vesi Reaktiot
Yhdistyy räjähdysvoimaisesti veden kanssa muodostaen happamuutensa vuoksi rikkihappoa Rikkitrioksidi pilkkoo useimmat orgaaniset aineet. Ilmaan joutuessaan rikkitrioksidi imee nopeasti kosteutta, jolloin syntyy tiheää valkoista höyryä .
Reaktiivisuusprofiili
Rikkitrioksidin ja happidifluoridin reaktio on hyvin voimakas ja räjähdyksiä tapahtuu, jos reaktio suoritetaan ilman liuotinta . Rikkitrioksidin reaktio ylijäämässä tetrafluorieteenin kanssa aiheuttaa räjähdysmäisen hajoamisen karbonyylifluoridiksi ja rikkidioksidiksi . Vedetön perkloorihappo reagoi rikkitrioksidin kanssa rajusti ja siihen liittyy huomattavaa lämmön kehittymistä (Pascal 16:300 1931-34). Nestemäinen rikkitrioksidi reagoi rajusti nityylikloridin kanssa jopa 75 °C:ssa. Rikkitrioksidin ja lyijyoksidin reaktio aiheuttaa valkoista luminesenssiä . Jodin, pyridiinin, rikkitrioksidin ja formamidin yhdistelmä kehitti kaasun ylipaineistumisen useiden kuukausien jälkeen. Tämä johtuu rikkihapon hitaasta muodostumisesta, ulkoisesta vedestä tai formamidin dehydraatiosta syaanivedyksi.
Vaara
Hapettava aine, palovaara kosketuksissa orgaanisten materiaalien kanssa, räjähdysmäinen höyrynpaineen nousu tapahtuu, kun α-muoto sulaa. Anhydridiyhdistyy veden kanssa muodostaen rikkihappoa ja kehittää lämpöä. Erittäin myrkyllinen, ärsyttää voimakkaasti kudoksia.
Terveysvaara
Rikkitrioksidi on erittäin myrkyllistä. Se ärsyttää ja syövyttää limakalvoja. Myrkyllistä hengitettynä tai nieltynä. Kosketus aiheuttaa vakavia palovammoja iholle ja silmiin.
Palovaara
Palovaara joutuessaan kosketuksiin orgaanisten materiaalien kanssa. Räjähdysmäinen höyrynpaineen nousu tapahtuu, kun alfa-muoto sulaa. Yhdistyy veden kanssa räjähdysvoimaisesti muodostaen rikkihappoa. Voi sytyttää muita palavia materiaaleja (puu, paperi, öljy jne.). Syttyviä myrkyllisiä kaasuja voi kerääntyä säiliöihin ja säiliövaunuihin. Hulevedet viemäriin voivat aiheuttaa tulipalo- tai räjähdysvaaran. Muodostaa rikkihappoa joutuessaan kosketuksiin veden kanssa. Vältä vettä ja orgaanisia materiaaleja. Ilmaan joutuessaan rikkitrioksidi imee itseensä kosteutta ja kehittää tiheitä valkoisia höyryjä.
Turvallisuusprofiili
Myrkyllistä hengitettynä. Ihmisen systeemiset vaikutukset hengitettynä: yskä ja muut keuhko- ja hajumuutokset. Ihoa, silmiä ja limakalvoja syövyttävä ärsyttävä aine. Voimakas reaktio O2F2:n, PbO:n, NClO2:n, HClO4:n, P:n, tetrafluorieteenin, asetonitriilin, rikkihapon, dimetyylisulfoksidin, dioksaanin, veden, difenyylielohopean, formamidin, jodin, pyridiinin, metallioksidien kanssa. Reagoi höyryn kanssa muodostaen syövyttäviä, myrkyllisiä rikkihappohuuruja. Kuumennettaessa hajoamiseen vapautuu myrkyllisiä SO, -höyryjä. Katso myös RIKKUHAPPO.
Potentiaalinen altistuminen
Rikkitrioksidia käytetään pesuaineiden, voiteluöljyjen lisäaineiden ja muiden orgaanisten yhdisteiden sulfatointi- ja sulfonointiaineena; aurinkoenergian keräimissä. Sitä käytetään myös välituotteena rikkihapon valmistuksessa ja räjähteiden valmistuksessa.
varastointi
Rikkitrioksidin höyrynpaine nousee nopeasti lämpötilan noustessa, ja kun α-muoto sulaa, paineen nousu on räjähdysaltis; siksi kuljetus- ja varastointisäiliöiden on kestettävä 10-15 atm:n paineita. Rikkitrioksidi reagoi voimakkaasti ja erittäin eksotermisesti veden kanssa tuottaen rikkivetyhappoa. Kun se altistuu kostealle ilmalle, se höyrystyy ja muodostaa rikkihapposumun, joka lopulta täyttää kaiken käytettävissä olevan tilan; se myös syövyttää metalleja. Se on voimakas hapetin, ja nestemäisessä faasissa se hiiltää orgaanisia materiaaleja.
Kuljetus
UN1829 Rikkitrioksidi, stabiloitu, Vaaraluokka: 8; Merkinnät: 8- Syövyttävä aine, 6.1- Myrkyllinen hengitysvaara, Hengitysvaaravyöhyke B.
Yhteensopimattomuudet
Palava ja syövyttävä. Voimakas hapetin. Reagoi voimakkaasti veden, höyryn tai kosteuden kanssa vapauttaen syövyttävää rikkivetyhappoa. Voimakkaita reaktioita tapahtuu joutuessaan kosketuksiin voimakkaiden emästen, voimakkaiden happojen, kemiallisesti aktiivisten metallien, pelkistävien aineiden, hienojakoisen metallin, syanidien, nitraattien, pikraattien, fulminaattien, kloraattien, sulfidien, karbidien, fosforin, happidifluoridin, bariumoksidin, lyijyoksidin, difenyylielohopean, alkoholien, nitryylikloridin, asetonitriilin, dioktaanin, tetrafluorieteenin kanssa.
Hävittäminen
Palauta uudelleen täytettävät paineistetut kaasupullot toimittajalle. Ei-täytettävät kaasupullot tulee hävittää paikallisten, osavaltioiden ja liittovaltion määräysten mukaisesti. Anna jäljellä olevan kaasun poistua hitaasti ilmakehään eristämättömässä tilassa tai poistohupussa. Uudelleentäytettävät kaasupullot on palautettava alkuperäiselle toimittajalle siten, että kaikki venttiilin korkit ja ulostulotulpat on kiinnitetty ja venttiilin suojakorkit ovat paikoillaan.