- Prilosec OTC -valmisteyhteenveto
- 1.1 Usein esiintyvän närästyksen luonnehdinta
- 1.2 Itsehoitolääkkeet närästykseen
- Kuvaus
- koostumus
- 3.1 Vaikuttava aine
- 3.2 Vaikuttavat aineet
- Kliininen farmakologia
- 4.1 Vaikutusmekanismi
- 4.2 Mahahapon erityksen esto
- 4.3 Farmakokinetiikka
- Kliiniset tehokkuustutkimukset
- 5.1 Ensisijaisen tehon päätetapahtuman tulokset (närästyksestä vapaa 24 tunnin ajan)
- 5.2 Toissijaisen tehon päätepisteen tulokset (ei yöllistä närästystä ja ei enempää kuin lievää närästystä)
- OTC-valmisteen etiketin ymmärtäminen ja vaatimustenmukaisuus
- 6.1 Vaatimustenmukaisuustutkimuksen tulokset
- Indikaatio ja käyttö
- Turvallisuus
- 8.1 Vasta-aiheet
- 8.2 Yhteisvaikutukset lääkkeiden kanssa
Prilosec OTC -valmisteyhteenveto
Tässä ovat kaikki tiedot, joita tarvitset Prilosec OTC -valmisteen parempaan ymmärtämiseen ennen kuin suosittelet sitä potilaille.
Prilosec OTC (omepratsoli 20 mg omepratsolimagnesiumina 20,6 mg) on hyväksytty Yhdysvaltain elintarvike- ja lääkeviraston (Food and Drug Administration) hyväksymänä käsikauppalääkkeenä (OTC-lääke) usein esiintyvän närästyksen hoitoon, joka on määritelty närästykseksi, jota esiintyy kahtena tai useampana päivänä viikossa. Prilosec OTC:n myötä terveydenhuollon ammattilaisilla on käsikauppalääkevaihtoehto, jota he voivat suositella aikuispotilaille, joilla on usein esiintyviä närästysoireita.
Aiemmin itsehoitoa tarvitsevien kuluttajien hoitovaihtoehtoihin ovat kuuluneet antasidit ja H2-reseptoriantagonistit (H2RA). Nyt kuluttajat saavat käyttöönsä PPI-valmisteita, mukaan lukien POTC, joka on pitkäkestoinen hoitovaihtoehto usein esiintyvien närästysoireiden hallintaan – yksi annos päivässä toimii jopa 24 tuntia osana 14 päivän hoitojaksoa. Tässä osiossa annetaan yleiskatsaus usein närästävistä oireista kärsivistä potilaista ja heidän hoitotottumuksistaan.
1.1 Usein esiintyvän närästyksen luonnehdinta
Närästystä kuvataan rintakehän puolivälin epämukavuuden tunteena, joka siirtyy kurkkuun ja kaulaan ja johon liittyy polttava tai kivulias tunne rintalastan alla. Vuonna 2003 tehdyn tutkimuksen mukaan Yhdysvalloissa noin 65 % koko aikuisväestöstä kokee närästystä, ja närästystä esiintyy päivittäin noin 15 miljoonalla aikuisella.1a
Hieman useammat naiset (59 %) kuin miehet raportoivat usein esiintyvästä närästyksestä.1a,2 Usein närästyksestä kärsivän kuluttajan keski-ikä on 45-50 vuotta1a,1a, ja närästys lisääntyy hieman iän myötä.2 Maantieteellisellä sijainnilla, siviilisäädyllä, perheasemalla (lapset), koulutustasolla, työpaikan tyypillä ja tasolla sekä sosioekonomisella asemalla on merkitystä taipumukseen sairastua närästykseen.3
Kuvassa 1 on esitetty kaikkien närästysepisodien esiintymistiheys vuonna 2003 tehdyssä tutkimuksessa, johon osallistui edustava aikuisten närästysväestö.1a
Kuva 1. Närästyksen esiintymistiheys yhdysvaltalaisessa närästysväestössä1a

Kuluttajat, joilla on usein närästystä, ilmoittivat, että heillä on ollut pitkään närästysoireita.
Enemmistö kuluttajista, joilla on usein närästystä, on keskustellut oireistaan terveydenhuollon ammattilaisten kanssa. Useimmat kuluttajat, joilla on usein närästystä (62 %), ovat ilmoittaneet oireistaan perusterveydenhuollon lääkärille, 16 % on käynyt gastroenterologin tai kardiologin vastaanotolla ja 2 % apteekkihenkilökunnan kanssa.1a
1.2 Itsehoitolääkkeet närästykseen
Vähemmistö kuluttajista, joilla on usein närästystä, tekee itsediagnoosin itse ja käyttää itsehoitoa saatavilla olevilla reseptivapaasti myytävillä lääkkeillä. Vuonna 2001 tehdyssä tutkimuksessa noin 80 prosenttia usein närästyksestä kärsivistä ilmoitti käyttävänsä itsehoitolääkkeitä.1a
Tässä tutkimuksessa yli 70 prosenttia usein närästyksestä kärsivistä piti oireitaan keskivaikeina tai vaikeina, ja useimmat usein närästyksestä kärsivät ilmoittivat käyttävänsä lääkkeitä oireiden ilmaantuessa niiden pahenemisen estämiseksi tai niiden lievittämiseksi. Yleisesti ottaen usein närästyksestä kärsivät kuluttajat ilmoittivat hallitsevansa närästystään käyttämällä antasideja yksinään tai yhdistettynä OTC H2RA-lääkkeisiin tai reseptillä saataviin PPI-lääkkeisiin.1a
Kuvaus
Prilosec OTC -valmistetta toimitetaan 14 tabletin, 28 tabletin ja 42 tabletin koossa. Nämä koot sisältävät yhden, kaksi ja kolme 14 päivän hoitojaksoa. Prilosec OTC on vaaleanpunainen (lohenpunainen) tabletti, joka koostuu useista suolistopäällysteisistä pelleteistä, jotka on formuloitu 20,6 mg:lla omepratsolimagnesiumia, joka vastaa 20 mg omepratsolia. Vaikuttava aine on omepratsolin magnesiumsuola, joka mahdollistaa tabletin annostelun. Prilosec OTC on saatavana myös Wildberryn makuisena tablettina, joka antaa makupurkauksen tablettia nieltäessä. Prilosec OTC Wildberry -valmistetta ei ole tarkoitettu pureskeltavaksi tai imeskeltäväksi. Se on violetin värinen tabletti ja sitä on saatavana 14 ja 42 ct:n koossa. Tätä tablettivalmistetta markkinoidaan tällä hetkellä OTC-valmisteena Ruotsissa ja reseptivalmisteena yli 30 muussa maassa. 1a
koostumus
3.1 Vaikuttava aine
Prilosec OTC -viivytystablettien vaikuttava aine on omepratsolimagnesium; sen kemiallinen nimi on di-5-metoksi-2-sulfinyyli]-1H-bentsimidatsolimagnesium. Omepratsolimagnesiumin molekyylipaino on 713,1. Sen rakennekaava on esitetty kuvassa 2.4
Omepratsolimagnesium on kiteinen aine, joka liukenee vapaasti metanoliin ja liukenee vähän veteen. Omepratsoli magnesium dissosioituu nopeasti vedessä muodostaen omepratsolia ja magnesiumia.4
Kuvio 2. Omepratsoli magnesium. Omepratsolimagnesiumin kemiallinen rakenne4

3.2 Vaikuttavat aineet
Prilosec OTC Vaikuttavat aineet: Glyseryylimonostearaatti, hydroksipropyyliselluloosa, hypromelloosi, rautaoksidi, magnesiumstearaatti, metakryylihappokopolymeeri, mikrokiteinen selluloosa, parafiini, polyetyleeniglykoli 6000, polysorbaatti 80, polyvinyylipyrrolidoni, natriumstearyylifumaraatti, tärkkelys, sakkaroosi, talkki, titaanidioksidi, trietyylisitraatti.5
Prilosec OTC villiviinimarja aromi Vaikutusaineet: FD&C blue no. 2 aluminum lake, FD&C red no. 40 alumiinijärvi, aromi, glyseryylimonostearaatti, hydroksipropyyliselluloosa, hypromelloosi, magnesiumstearaatti, metakryylihappokopolymeeri, kiille, mikrokiteinen selluloosa, polyetyleeniglykoli 6000, polysorbaatti 80, polyvinyylipyrrolidoni, sakariininatrium, natriumstearyylifumaraatti, tärkkelys, sakkaroosi, talkki, titaanidioksidi, trietyylisitraatti
Kliininen farmakologia
4.1 Vaikutusmekanismi
Omepratsoli kuuluu lääkeryhmään, joka tunnetaan nimellä substituoidut bentsimidatsolit.6 Omepratsoli sitoutuu irreversiibelisti protonipumppuun (H+/K+-ATPaasi-entsyymijärjestelmä) mahalaukun parietaalisolun erittävällä pinnalla.6-8 Sitoutuminen estää tai suppressoi parietaalisolun kykyä erittää mahahappoa (kuva 3).
Kuva 3. Omepratsolin vaikutusmekanismi4

Kliininen farmakologia
4.2 Mahahapon erityksen esto
Mahahapon takaisinvirtaus ruokatorveen on tärkein syy närästysoireisiin. Omepratsoli estää sekä basaalista että stimuloitua hapon eritystä parietaalisoluista ärsykkeestä riippumatta. Mahalaukun parietaalisolujen haponeritys on 24 tunnin kuluttua noin 50 % maksimiannoksesta kerta-annoksella. Kun omepratsolin käyttö lopetetaan, mahahapon erityskyky palautuu vähitellen päivien kuluessa, kun uusia protonipumppuja syntyy.4
Farmakodynaamiset tiedot osoittivat, että 20 mg:n vuorokausiannoksella omepratsoli aiheuttaa voimakkaan ja johdonmukaisen mahahapon erityksen eston 24 tunnin aikana.4 Tämän vaikutuksen suuruusluokka ja johdonmukaisuus olivat merkittävästi paremmat 20 mg:n kuin 10 mg:n vuorokausiannoksella omepratsolia käytettäessä. Kuvio 4 havainnollistaa 20 mg:n tai suuremmilla annoksilla annetun omepratsolin ylivoimaista ja johdonmukaisempaa antisekretorista vaikutusta.9 Siitä nähdään myös, että 20 mg:n vuorokausiannos omepratsolia saa aikaan selvästi voimakkaamman ja johdonmukaisemman eston kuin pienemmät annokset, mutta ei täydellistä mahahapon erityksen estoa 24 tunnin annosteluvälien aikana.
Kuva 4. Yhden viikon vuorokausiannoksilla annetun omepratsolin hoidon estovaikutus 24 tunnin mahansisäiseen happojen eritykseen9

4.3 Farmakokinetiikka
Hyötyosuus
Tutkimus, johon osallistui 29 tervettä yhdysvaltalaista henkilöä. koehenkilöitä osoitti, että Prilosec OTC -tablettien biologinen hyötyosuus on samanlainen kuin kaupallisesti saatavilla olevien 20 mg:n reseptilääkkeenä saatavien Prilosec® (omepratsoli) -kapselien biologinen hyötyosuus (ks. kuva 5).4 Koehenkilöille annettiin hoitovalmistetta aamun kerta-annoksena paastoiduissa olosuhteissa. Tutkimus oli satunnaistettu, avoin, ristikkäistutkimus, jossa hoitojen välillä oli viiden päivän huuhtelujakso. Tablettivalmistetta markkinoidaan Ruotsissa käsikauppavalmisteena ja yli 30 muussa maassa reseptivalmisteena.1a
Kuva 5. Omepratsolin keskimääräinen pitoisuus plasmassa ajan funktiona: koehenkilöt, joilla on arvioitavissa olevia farmakokineettisiä tietoja (n = 29)4

Asbsorptio, jakaantuminen ja aineenvaihdunta
Koska Prilosec OTC -tablettien omepratsolimagnesiumia sisältävät pelletit ovat suolen sisäelimistön kautta peittyneitä, tabletteja ei saa halkaista, koska tämä häiritsisi päällystettä. Suolistopäällysteen vuoksi imeytyminen alkaa vasta, kun tabletit ovat päässeet pohjukaissuoleen. Tämä on tärkeää, koska altistuminen mahalaukun happamalle ympäristölle ennen systeemiseen verenkiertoon pääsyä aiheuttaisi omepratsolimolekyylin hajoamista, mikä saattaisi rajoittaa sen lopullista tehoa. Kun omepratsolin magnesium liukenee tähän pohjukaissuolen lähes neutraaliin ympäristöön, omepratsoli-ioni muuttuu neutraaliin muotoonsa. Omepratsoli imeytyy samassa muodossa riippumatta siitä, annetaanko se vapaana omepratsolina vai omepratsolimagnesiumsuolana.10 Imeytyminen on nopeaa, ja omepratsolin huippupitoisuudet plasmassa (Cmax) saavutetaan 0,5-3,5 tunnin kuluessa oraalisesta annostelusta.4 Terveillä aikuisilla koehenkilöillä plasman puoliintumisaika (t1/2) on 0,5-1,0 tuntia ja elimistön kokonaispuhdistuma on 500-600 ml/min. Omepratsolin vaikutuksen kesto on yli 24 tuntia kerta-annoksen jälkeen, koska parietaalisolut muuttuvat noin kolmessa tai viidessä päivässä. Proteiiniin sitoutuminen on noin 95 %. Happojen erityksen esto on yhteydessä plasman pitoisuus-aikakäyrän alle jäävään pinta-alaan, mutta ei todelliseen plasmapitoisuuteen tiettynä ajankohtana.
Omepratsoli metaboloituu kokonaan maksassa sytokromi P450-isoentsyymien avulla. Ainakin kuusi metaboliittia muodostuu, joilla on vain vähän tai ei lainkaan antisekretorista aktiivisuutta. Omepratsolin metaboliitit poistuvat ensisijaisesti virtsaan ja toissijaisesti ulosteeseen.4
Kliiniset tehokkuustutkimukset
Kaksi hyvin kontrolloitua kliinistä tutkimusta, joihin osallistui 3120 koehenkilöä, tukevat omepratsolimagnesiumin peräkkäisen 14 vuorokauden terapeuttisen hoidon käyttöä usein esiintyvän närästyksen hoitoon. Molemmat tutkimukset olivat monikeskustutkimuksia, kaksoissokkotutkimuksia, satunnaistettuja, rinnakkaistutkimuksia ja lumekontrolloituja. Kummassakin tutkimuksessa arvioitiin omepratsolimagnesiumin 10 mg:n ja 20 mg:n annoksia 14 peräkkäisen päivän ajan henkilöillä, joilla oli närästystä kahtena tai useampana päivänä viikossa.1a
Tutkimuksissa oli viikon pituinen lumelääkkeellinen sisäänajovaihe närästystiheyden arvioimiseksi. Osallistumiskelpoiset koehenkilöt satunnaistettiin kahden viikon kaksoissokkohoitovaiheeseen saamaan päivittäin joko omepratsolimagnesiumin 10 mg:n, omepratsolimagnesiumin 20 mg:n tai plasebon kerta-annoksen joka päivä. Koehenkilöt ottivat päivittäisen tutkimuslääkeannoksensa joka aamu ennen aamiaista.1a
Ensisijainen tehon päätetapahtuma oli ”ei närästystä edellisen 24 tunnin aikana” (eli täysin närästyksetön koko päivän ajan). Tehoa arvioitiin ensimmäisen lääkeannoksen jälkeen, viimeisellä annoksella ja 14 päivän annostelun aikana kaksoissokkovaiheen aikana.1a
Ensimmäisen lääkeannoksen ja seuraavien annosten jälkeen tutkittiin myös useita toissijaisia tehon päätetapahtumia. Näitä olivat ”yöllisen närästyksen täydellinen ehkäisy” ja ”enintään lievän närästyksen esiintyminen”. 1b
5.1 Ensisijaisen tehon päätetapahtuman tulokset (närästyksestä vapaa 24 tunnin ajan)
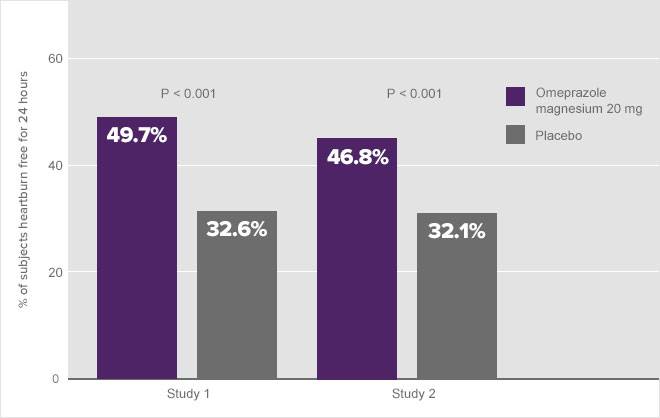
Kummassakin kliinisessä tutkimuksessa osoitettiin, että 20 mg:n omepratsolimagnesiumin annos johti merkittävään hoitovaikutukseen ensimmäisen päivän aikana. Kuten kuvasta 6 käy ilmi, lähes 50 % 20 mg omepratsolimagnesiumia saaneiden hoitoryhmien koehenkilöistä oli närästyksestä vapaita koko vuorokauden ajan ensimmäisen annoksen jälkeen verrattuna noin 32 %:iin lumelääkeryhmän koehenkilöistä (kuva 6).1a
Kuva 6. Niiden koehenkilöiden prosenttiosuus, joilla ei ollut närästystä 24 tuntiin- Päivä 11a
Päivänä 14 niiden koehenkilöiden prosenttiosuus, jotka ilmoittivat täydellisestä närästyksen lievittymisestä, oli yli 70 % (kuva 7).1a
Kuva 7. Niiden koehenkilöiden osuus, joilla ei ollut närästystä 24 tunnin ajanjakson aikana 14 päivän aikana1a

5.2 Toissijaisen tehon päätepisteen tulokset (ei yöllistä närästystä ja ei enempää kuin lievää närästystä)
Yleisesti ottaen näiden päätepisteiden tulokset vahvistivat ensisijaisten päätepisteiden tulokset.1a
Kun tehon päätepisteeseen lisättiin koehenkilöt, joilla oli vain lievää närästystä, yli 80 % omepratsolimagnesiumia saaneista raportoi merkittävästä terapeuttisesta hyödystä ensimmäisenä päivänä (kuva 8).1a
Kuva 8. Niiden koehenkilöiden osuus, joilla oli enintään lievää närästystä, 11. päivä 11a

OTC-valmisteen etiketin ymmärtäminen ja vaatimustenmukaisuus
6.1 Vaatimustenmukaisuustutkimuksen tulokset
Kuluttajakäyttäytymistä ja ymmärrystä Prilosec OTC -valmisteen käytöstä arvioitiin etikettien ymmärtämistutkimuksissa ja tosiasiallista käyttöä koskevassa tutkimuksessa. Tässä tutkimusohjelmassa selvitettiin merkintäohjeiden noudattamista ja valmisteen käyttöä valvomattomassa ympäristössä. Tarkemmin sanottuna ohjelma kehitettiin sen selvittämiseksi, ymmärsivätkö kuluttajat: 1) väestöryhmän, jolle Prilosec OTC soveltuu parhaiten (oma valinta, joka perustui närästyksen esiintymistiheyteen ja pakkausmerkintöjen varoitusmerkintöjen ymmärtämiseen); 2) milloin ja miten Prilosec OTC:tä otetaan (yksi tabletti päivässä 14 peräkkäisenä päivänä); ja 3) milloin on otettava yhteyttä terveydenhuollon ammattihenkilöstöön (erityisten varoitusmerkintöjen perusteella tai närästyksen palatessa). Todellista käyttöä koskevassa tutkimuksessa määritettiin etiketin ohjeiden noudattaminen todellisissa käyttöolosuhteissa.1a
-
Kunkin itsevalintakriteerin osalta asianmukainen valinta oli yli 90 % koko populaatiossa.
1a
-
Valmistetta käyttämään valinneet tutkittavat noudattivat hyvin tarkasti etiketissä annettuja annosteluohjeita: yli 91 % tutkittavista käytti valmistetta etiketin ohjeiden mukaisesti ottamalla enintään yhden tabletin annostelukertaa kohti ja enintään yhden tabletin päivässä.
1a
-
Kolmen kuukauden seurantahaastattelussa kuluttajat, jotka kokivat närästysoireiden palaavan, käyttäytyivät edelleen etiketin käyttöohjeiden mukaisesti.
1a
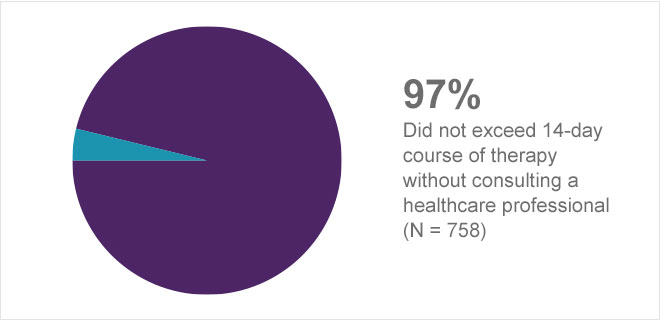
Näiden tutkimusten tulokset tukevat vahvasti Prilosec OTC -valmisteen asianmukaista käyttöä kuluttajalle, jolla on usein närästystä, ja tukevat kuluttajan kykyä käyttää valmistetta oikein ehdotettujen OTC-merkintäohjeiden mukaisesti (kuva 9).1a
Kuva 9. Annostelun noudattaminen1a
Indikaatio ja käyttö
Prilosec OTC 20 mg:n tabletit on tarkoitettu usein esiintyvän närästyksen hoitoon, joka määritellään närästykseksi, jota esiintyy kahtena tai useampana päivänä viikossa. Prilosec OTC -valmisteen pakkausmerkinnöissä annetaan seuraavat ohjeet tiheästi närästystä sairastavien kuluttajien tarkoituksenmukaisesta käytöstä5:

-
Yhden tabletin vuorokausiannos hoitaa tiheästi esiintyvää närästystä 24 tunnin ajan osana 14 vuorokauden kuuria.
-
QD-annostelu minimoi epämukavuuden ja kannustaa noudattamaan annosta.
-
Käytä 14 päivän annosteluohjelmaa usein esiintyvän närästyksen hoitoon.
-
Merkintäohjeissa kehotetaan kuluttajia kääntymään lääkärin puoleen.
-
Kuluttajia kehotetaan ottamaan enintään yksi 14 päivän hoitojakso neljän kuukauden välein, ellei lääkäri toisin määrää.
Turvallisuus
8.1 Vasta-aiheet
Prilosec OTC -valmiste on vasta-aiheinen niille, jotka ovat yliherkkiä omepratsolille. Kuluttajia, joilla on tiettyjä sairauksia ja/tai oireita, kehotetaan etiketissä joko olemaan käyttämättä valmistetta tai kääntymään lääkärin puoleen.5
8.2 Yhteisvaikutukset lääkkeiden kanssa
Omepratsolin (joka metaboloituu ensisijaisesti maksan sytokromi P450-isoentsyymin CYP2C19:n välityksellä) mahdollisia aineenvaihdunnallisia lääkeaineinteraktioita on tutkittu systemaattisesti erityisesti varfariinin, diatsepaamin, digoksiinin ja klopidogreelin suhteen.4
FDA:n terveysneuvonta annettu
Lue, miksi tietojen perusteella suositellaan välttämään Prilosec OTC:n (omepratsoli) ja Plavix®:n (klopidogreeli) yhdistelmää.
Vaikka varfariinin tai digoksiinin ja omepratsolin väliset kliinisesti merkittävät yhteisvaikutukset ovat epätodennäköisiä, näiden lääkeaineiden kapeampi terapeuttinen ikkuna on johtanut siihen, että nämä lääkeaineet on konservatiivisena varotoimenpiteenä lueteltu Prilosec OTC:n pakkausmerkinnässä.4
Lisäksi FDA on edellyttänyt pakkausmerkintöjä, joissa varoitetaan potilaita käyttämästä POTC:tä, jos he käyttävät:
cilostitsolia, reseptillä saatavia sienilääkkeitä tai sienilääkkeitä, diatsepaamia, digoksiinia, takroimusta, mykofenolaattimofetiiliä, reseptillä saatavia antoretroviraalilääkkeitä ja metotreksaattia.
Varfariini
Markkinoille tulon jälkeen on saatu raportteja protrombiinimittojen muutoksista potilailla, jotka ovat saaneet samanaikaista varfariini- ja omepratsolihoitoa. INR:n ja protrombiiniajan suureneminen voi johtaa epänormaaliin verenvuotoon ja jopa kuolemaan. PPI-valmisteilla ja varfariinilla samanaikaisesti hoidettuja potilaita voidaan joutua seuraamaan INR:n ja protrombiiniajan suurenemisen varalta.
Diatsepaami
Yhteiskäyttö diatsepaamin kanssa lueteltiin myös Varoitukset-osiossa, koska omepratsoli pienentää merkittävästi diatsepaamin puhdistumaa, vaikka diatsepaamin suhteellisen leveän terapeuttisen ikkunan vuoksi on epätodennäköistä, että tämä omepratsolin vaikutus olisi kliinisesti merkittävä.4
Antiretroviraaliset aineet
Omepratsolin samanaikaisen antamisen on raportoitu vaikuttavan antiretroviraalisten aineiden plasmapitoisuuksiin, joten asianmukaista kliinistä seurantaa suositellaan.
Metotreksaatti
Tiedot näyttävät viittaavan siihen, että omepratsolin ja metotreksaatin välinen lääkeaineinteraktio saattaa liittyä metotreksaatin vähentyneeseen eliminaatioon, mikä johtaa metotreksaatin toksisuuteen. Metotreksaatin reseptivalmisteiden hyväksytyissä pakkausmerkinnöissä ja kaikkien PPI-reseptivalmisteiden pakkausmerkinnöissä on tämä tieto.
Takrolimuusi
Omepratsolin ja takrolimuusin samanaikainen anto saattaa suurentaa takrolimuusin seerumipitoisuuksia.
Lääkkeet, joiden imeytyminen riippuu pH:sta
Kuten muutkin PPI:t ja H2RA:t, omepratsoli nostaa mahansisäistä pH:ta (vähentää happamuutta), mikä voi vaikuttaa sellaisten lääkkeiden imeytymiseen, joiden imeytyminen riippuu pH:sta, esim, ketokonatsoli, itrakonatsoli tai mykofenolaattimofetiili. Eräässä tutkimuksessa osoitettiin, että ketokonatsolin imeytyminen väheni huomattavasti omepratsolin antamisen jälkeen. Vastaavasti toinen tutkimus osoitti, että itrakonatsolin imeytyminen väheni, jos se annettiin kahden viikon omepratsolihoidon jälkeen.4
Mykofenolaattimofetiilin yhteiskäyttö PPI:n kanssa johtaa kirjallisuudessa mainittujen tutkimusten perusteella vähentyneeseen mykofenolaattimofetiilin systeemiseen altistumiseen.11 Vaikutus johtuu mahdollisesti PPI:n aiheuttamasta mahahapon suppressiosta, joka voi johtaa mykofenolaattimofetiilin epätäydelliseen liukenemiseen ja sitä seuraavaan huonoon imeytymiseen. Tämä tieto sisältyy nykyisiin mykofenolaattimofetiilin reseptilääkkeiden pakkausmerkintöihin.
Prilosec OTC:n pakkausmerkinnöissä luetellaan siis mahdolliset yhteisvaikutukset näiden lääkkeiden kanssa lääketietolaatikon Varoitukset-osiossa.5
Erityisryhmät
Käyttö raskauden ja imetyksen aikana: Prilosec OTC -valmisteen pakkausmerkinnöissä kehotetaan raskaana olevia tai imettäviä naisia ottamaan yhteyttä lääkäriin ennen käyttöä.5
Käyttö lapsille: Prilosec OTC on tarkoitettu usein esiintyvän närästyksen hoitoon 18 vuotta täyttäneille. Alle 18-vuotiaille lapsille, joilla on usein esiintyvää närästystä, etiketissä neuvotaan neuvottelemaan lääkärin kanssa ennen käyttöä.5
haittavaikutukset
Lääkärit ovat määränneet omepratsolia miljoonille potilaille happamuuteen liittyvien sairauksien hoitamiseksi turvallisesti.7
Omepratsolin turvallisuus vahvistettiin 15:ssä uudessa kliinisessä tutkimuksessa, jotka tehtiin OTC-valmisteena annosteltavan omepratsolin ja omepratsolimagnesiumin kanssa tehdyissä kliinisissä tutkimuksissa (n > 18 000). Yleisimmät haittavaikutukset olivat päänsärky ja ripuli, jotka vastasivat kliinisissä tutkimuksissa ja reseptilääkkeellä myytävän Prilosecin markkinoille tulon jälkeisessä seurannassa todettuja haittavaikutuksia. Prilosec OTC:n siedettävyysprofiili oli samanlainen kuin lumelääkkeellä.1a
Saatavuus ja varastointi
Prilosec OTC -tabletit 20 mg:n annoksina toimitetaan läpipainopakkauksissa. Prilosec OTC on saatavilla OTC-valmisteena kolmessa eri koossa 5:
-
Pakkaus, jossa on 14 tablettia (yksi 14 päivän hoitojakso)
-
Pakkaus, jossa on 28 tablettia (kaksi 14 päivän hoitojaksoa)
-
Pakkaus, jossa on 42 tablettia (kolme 14 päivän hoitojaksoa)
Prilosec OTC Villivadelma-maustetut tabletit annoksella 20 mg toimitetaan läpipainopakkauksissa. Prilosec OTC Wildberry Flavor on saatavilla OTC-valmisteena kahdessa eri koossa5:
-
Pakkaus, jossa on 14 tablettia (yksi 14 päivän hoitojakso)
-
Pakkaus, jossa on 42 tablettia (kolme 14 päivän hoitojaksoa)
Varastointiolosuhteet
-
Varastoi 20 °C:n ja 25 °C:n välillä. 5
-
Suojata kosteudelta. 5
1a Tiedostossa olevat tiedot. Procter & Gamble.
1b Prilosec OTC™ -valmisteen (omepratsolimagnesium 20,6 mg) vertailu lumelääkkeeseen 14 päivän ajan usein esiintyvän närästyksen hoidossa. Journal of Clinical Pharmacy and Therapeutics. 2005;30:105-112.
2 Oliveria SA, Christos PJ, Talley NJ, ym. närästyksen riskitekijät, tietämys ja ennaltaehkäisystrategiat: väestöpohjainen kyselytutkimus närästyksestä kärsiville henkilöille. Arch Intern Med. 1999;159:1592-1598.
3 Tarvitsevien kuluttajien profiili. Kun etelä nousee taas, se on luultavasti vain kaasua: kevytmielinen katsaus raskaisiin vatsoihin. Progressive Grocer 1995;98-99.
sup>4 Tiedostossa olevat tiedot. AstraZeneca LP.
5 Prilosec OTC . Cincinnati, Ohio: Procter & Gamble; 2015.
6 Massoomi F, Savage J, Destache CJ. Omepratsoli: kattava katsaus. Pharmacotherapy 1993;13:46-59.
7 Prilosec . Wilmington, Del: AstraZeneca LP; 2015.
8 Lindberg P, Brändström A, Wallmark B, et al. Omeprazole: the first proton pump inhibitor. Med Res Rev. 1990;10:1-54.
9 Lind T, Cederberg C, Axelson M, ym. Omepratsolin eri vuorokausiannosten pitkäaikainen happoa estävä vaikutus 24 tuntia annostelun jälkeen. Scand J Gastroenterol. 1986;21(suppl 118):137-138.
10 Losec . Auckland, Uusi-Seelanti: AstraZeneca Limited; 2015.
11Protonipumpun estäjien merkitys varhaiseen mykofenolihappoaltistukseen munuaisensiirrossa: näyttöä CLEAR-tutkimuksesta. Kiberd BA, Wrobel M, Danavino R, et al. Ther Drug Monit. 2011 Feb; 33(1):120-3; Protonipumpun estäjät vähentävät mykofenolaattialtistusta sydämensiirron saaneilla – prospektiivinen tapauskohtainen kontrolloitu tutkimus. Kofler S, Shvets N, Bigdeli AK, et al. Amer J. Transplant. 2009 Jul; 9(7):1650-6. Epub 2009 June 10.
.