Oletko koskaan miettinyt, miksi hehkutikut (ks. kuva 1) hehkuvat sen jälkeen, kun niitä on taivutettu? Tai miksi nuo muovitähdet hehkuvat vielä yöllä, kun valot on sammutettu? Et ehkä ole. Olitpa kuitenkin kysynyt itseltäsi näitä kysymyksiä tai et, seuraavasta tekstistä saat toivottavasti vastauksia ja selityksiä hehkuviin rannekkeisiin, hohtaviin meduusoihin, mustaan valoon ja moneen muuhun ilmiöön.

Kuvio 1. Hehkulamput. Hehkutikkuja.
Luminesenssi
Yleisesti kaikissa edellä mainituissa ilmiöissä esiintyvää hehkua kutsutaan luminesenssiksi. Luminesenssi on aineesta valon muodossa vapautuvaa energiaa . Luminesenssia voidaan erottaa useita eri tyyppejä:
- Yksi esimerkki on kemiluminesenssi. Joidenkin kemiallisten reaktioiden aikana energiaa vapautuu valona. Tämä tapahtuu hehkutikun taivuttamisen jälkeen. Se on myös syy eläinten, kuten meduusojen tai joidenkin mikro-organismien, hehkumiseen. Tällöin sitä kutsutaan bioluminesenssiksi .
- Toinen laji on triboluminesenssi. Se voidaan havaita, kun itseliimautuva kirjekuori avataan täydellisessä pimeydessä tai kun teippi rullataan irti pimeässä huoneessa. Tällöin systeemiin syötetään mekaanista energiaa, joka toimii hehkun aktivaattorina .
- Luultavasti tunnetuin luminesenssilaji on fotoluminesenssi. Tässä energiaa saadaan sähkömagneettisesta säteilystä, esimerkiksi auringonvalosta tai ultraviolettilampusta, kuten joissakin diskoissa. Tämä aiheuttaa ilmiöitä, kuten muovitähtien jatkuvaa hehkua tai valkoisten vaatteiden äärimmäistä kirkkautta mustassa valossa. Voidaan erottaa toisistaan fluoresenssi ja fosforesenssi, jotka selitetään jäljempänä .
Mikä on elektronisesti kiihdytetty tila?
Yleisesti kaikenlainen luminesenssi perustuu niin sanottuihin fotofysikaalisiin prosesseihin. Yleensä itse molekyylejä kuvataan fluoresoiviksi. Näin on fluoresoivien väriaineiden, kuten fluoresceiinin tai kurkumiinin, kohdalla. Valofysikaalisten prosessien selittämiseksi on kuitenkin katsottava tarkemmin vielä molekyylitasoa pienemmälle tasolle.
Erilaisten alkuaineiden atomeilla on erilainen määrä elektroneja, jotka on jaettu useisiin kuoriin ja orbitaaleihin. Elektronit ovat eräänlaisia alkeishiukkasia. Elektroniset siirtymät ovat vastuussa luminesenssista . Kun systeemi absorboi energiaa, elektronit virittyvät ja nousevat korkeamman energian tilaan. Ennen herätystä, perustilassa, osa elektroneista on niin sanotussa HOMO:ssa (Highest Occupied Molecular Orbital). Kun ne ovat päässeet virittyneeseen tilaan, ne ovat LUMO:ssa (Lowest Unoccupied Molecular Orbital) (ks. kuva 2). Miten tämä tarkalleen ottaen toimii, selitetään käyttämällä erityisenä esimerkkinä fotoluminesenssia.

Kuva 2. Elektroninen heräte.
Atomin tai molekyylin erilaisia energiatiloja kutsutaan ”energiatasoiksi”. Molekyylistä ja atomista riippuen elektronit voivat olla vain erillisillä energiatasoilla, koska energia on kvantittunut, mikä tarkoittaa, että energiaa voidaan absorboida ja emittoida vain tiettyjä määriä . Kahden tason välinen ero voidaan laskea yhtälöllä 1 (jossa E2 on korkeampi energiataso ja E1 alempi).
(1) ΔE = E2-E1
Fotoneilla, hiukkasilla, joista sähkömagneettinen säteily tai valo koostuu, on oltava tietty energia-arvo, jotta ne voivat herättää elektroneja. Fotonin energia voidaan laskea yhtälöllä 2, jossa h on Planckin vakio ja ν on valon taajuus.
(2) Efotoni = hν
Elektronien tarvitsema kiihdytysenergia on yhtä suuri kuin energiatasojen välinen ero. Vain valolla, jolla on tietty energia ja vastaavasti tietty taajuus ja aallonpituus, voidaan herättää elektroneja . Tasoittamalla yhtälöt 1 ja 2 ja yhtälön 3 avulla (jossa c tarkoittaa valon nopeutta) voidaan laskea tarvittava taajuus ja aallonpituus (ks. yhtälö 4) . Monissa tapauksissa herättämiseen käytetään UV-säteilyä.
(3) λ = c/ν
(4) ΔE = Ephoton ⇔ E2 – E1 = hν
ν = (E2 – E1)/h
λ = hc/(E2 – E1)
Elektronisesti kiihottuneiden tilojen deaktivoituminen
Tällaiset elektronisesti kiihottuneet tilat ovat epävakaita. Elektronit putoavat takaisin perustiloihinsa. Samalla heräte-energia vapautuu uudelleen. Erotetaan säteilevät ja ei-säteilevät hajoamisprosessit. Useimmiten hajoaminen on ei-säteilyä, esimerkiksi värähtelyrelaksaation, ympäröivien molekyylien aiheuttaman sammumisen tai sisäisen muuntumisen (IC) kautta. Nämä prosessit selitetään yksityiskohtaisesti myöhemmin.
Joskus säteilevä hajoaminen voi tapahtua fluoresenssin ja fosforesenssin muodossa. Energia emittoituu sähkömagneettisena säteilynä tai fotoneina. Emittoituneella valolla on pidempi aallonpituus ja pienempi energia kuin absorboituneella valolla, koska osa energiasta on jo vapautunut ei-säteilevässä hajoamisprosessissa . Tämä on syy siihen, että näkyvän spektrin emissio voidaan saada aikaan herättämällä ei-näkyvän UV-säteilyn avulla. Tätä siirtymää kohti pidempää aallonpituutta kutsutaan Stokesin siirtymäksi .
Vertailu: Fluoresenssi vs. fosforesenssi
Sekä fluoresenssi että fosforesenssi ovat sähkömagneettisen säteilyn spontaaneja emissioita. Erona on se, että fluoresenssin hehku loppuu heti sen jälkeen, kun kiihottavan säteilyn lähde on sammutettu, kun taas fosforesenssissa voi esiintyä jälkihehkua, jonka kesto voi olla sekunnin murto-osista jopa tuntikausiin .
Vertaillaksemme molempien ilmiöiden taustalla olevia fotofysikaalisia prosesseja, on olemassa joitakin elektroneihin liittyviä tosiasioita, jotka auttavat ymmärtämään: Elektronit ovat hiukkasia, joilla on ns. spin ja spin-kvanttiluku. Tällä voi olla kaksi eri arvoa, eli joko +1/2 tai -1/2 . Tämä luku on ominaisuus, jota emme itse asiassa voi kuvitella tai kuvata helposti. Sitä verrataan usein pyörivään kärkeen, joka pyörii joko myötä- tai vastapäivään. Tämä kuvaus ei kuitenkaan ole matemaattisesti eikä fysikaalisesti aivan oikea. Atomin yhden orbitaalin kahdella elektronilla on antiparalleelinen spin, joka merkitään (↓) .
Fluoresenssi
Fluoresenssin Jablonski-diagrammissa (ks. kuva 3) singlettispinitila S0 on elektronien perustila, ja S1 ja S2 ovat singlettijännitystiloja (tiloja käytetään tässä tekstissä vain esimerkkinä eivätkä ne välttämättä päde tiettyihin atomeihin, molekyyleihin jne.) Näiden tilojen sisällä on useita energiatasoja. Mitä korkeampi taso on, sitä enemmän energiaa elektronilla on kyseisellä tasolla ollessaan. Singlettitilojen tapauksessa elektroneilla on antiparalleeliset spinit.

Kuva 3. Fluoresenssin Jablonski-diagrammi.
Elektronit nousevat esimerkiksi perustilasta S0 toisen kiihottuneen tilan S2 energiatasolle, kun niitä kiihdytetään sähkömagneettisella säteilyllä. Kun heräte loppuu, elektronit pysyvät kyseisessä herätetyssä tilassa vain lyhyen aikaa (n. 10-15 s) ja alkavat sitten välittömästi laskea takaisin perustilaan . Tällöin energiaa voi aluksi vapautua ympäristöön värähtelyrelaksaation kautta. Tämä tarkoittaa, että lämpöenergiaa vapautuu atomin tai molekyylin liikkeestä, kunnes toisen kiihdytetyn tilan alin taso on saavutettu.
Kakkos- ja ensim m äisen kiihdytetyn tilan välinen suurempi kuilu ylitetään sisäisellä konversiolla. Tämä kuvaa elektronista siirtymää kahden tilan välillä elektronien spinin säilyessä. Nyt elektronit voivat relaksoitua lisää värähtelyrelaksaation ansiosta, kunnes ne saavuttavat S1-tilan alimman energiatason.
Teoreettisesti elektronit voisivat relaksoitua vielä lisää säteilemättömällä tavalla, kunnes ne lopulta saavuttavat taas perustilan. Voi kuitenkin olla, että viimeinen energiamäärä on liian suuri vapautuakseen ympäristöön, koska ympäröivät molekyylit eivät pysty absorboimaan näin paljon energiaa. Tällöin syntyy fluoresenssi, joka johtaa tietyn aallonpituuden omaavien fotonien emissioon. Emissio kestää vain siihen asti, kunnes elektronit ovat jälleen perustilassa. Koska kaikkien näiden siirtymien aikana elektronin spin pysyy samana, niitä kuvataan spin-sallituiksi .
Fosforesenssi
Fosforesenssissa asiat ovat hieman toisin (ks. kuva 4). On taas olemassa S0-perustila ja kaksi kiihdytettyä tilaa, S1 ja S2. Lisäksi on olemassa kiihdytetty tripletti T1-tila, joka sijaitsee energeettisesti S0- ja S1-tilojen välissä. Elektronien spinit ovat jälleen antiparalleelisia perustilassa.
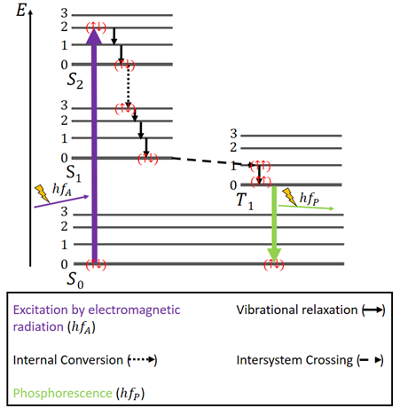
Kuvio 4. Elektronien spinit. Fosforesenssin Jablonski-diagrammi.
Heräte tapahtuu samalla tavalla kuin fluoresenssissa eli sähkömagneettisen säteilyn avulla. Energian vapautuminen värähtelyrelaksaation ja sisäisen muuntumisen kautta saman spinin pysyessä samana on tässäkin sama, mutta vain kunnes S1-tila saavutetaan.
Singlettitilojen rinnalla on olemassa triplettitila, ja niin sanottua systeemien välistä ristiinkytkentää (intersystem crossing, ISC) voi tapahtua, koska T1-tila on energeettisesti edullisempi kuin S1-tila. Tämä ylitys, kuten sisäinen konversio, on elektroninen siirtymä kahden kiihdytetyn tilan välillä. Mutta toisin kuin sisäisessä konversiossa, ISC:hen liittyy spinin kääntyminen singletistä triplettiin. Triplettitilassa olevilla elektroneilla on rinnakkaiset spinit, mikä merkitään () . Tätä ISC-prosessia kuvataan nimellä ”spin-kielletty”. Se ei ole täysin mahdotonta – johtuen ilmiöstä nimeltä ”spin-orbit-kytkentä” – mutta se on kuitenkin melko epätodennäköistä .
T1-tilassa myös ei-säteilevä hajoaminen on mahdollista. Siirtymä triplettitilan alimmalta energiatasolta S0-tilaan ei kuitenkaan ole helposti mahdollinen, koska sekin siirtymä on spin-kielletty. Silti se voi kuitenkin tapahtua pienellä todennäköisyydellä. Se aiheuttaa melko heikon fotoniemission, koska elektronin spin on käännettävä uudelleen. Energia on loukussa tässä tilassa jonkin aikaa ja voi vapautua vain hitaasti. Kun kaikki energia on vapautunut, elektronit ovat taas perustilassa .
Johtopäätökset
Spinin sallimat ja kielletyt prosessit toimivat selityksinä fluoresenssin välittömästi loppuvalle hehkulle ja fosforesenssin jälkihehkulle. Fosforesenssia esiintyy yleensä vain ”raskaammilla” molekyyleillä, koska spin on käännettävä spin-orbit-kytkennän avulla. Se, emittoituuko sähkömagneettista säteilyä lainkaan ja millä aallonpituudella, riippuu siitä, kuinka paljon energiaa voidaan vapauttaa etukäteen säteilemättömällä hajoamisella . Se riippuu myös niin sanottujen sammuttajien ominaisuuksista, jotka ovat ympäröiviä molekyylejä ja pystyvät ottamaan suurempia määriä energiaa.
Kaikki prosessit, jotka voivat johtaa säteilevien hajoamisten estymiseen, voivat aiheuttaa fluoresenssin sammumista. Esimerkkejä ovat ei-säteilevät hajoamisprosessit, mutta myös fluoresoivan molekyylin tuhoutuminen . Kvanttitehokkuus kuvaa prosessin tehokkuutta, ja se määritellään absorboituneiden ja emittoituneiden fotonien suhteena . Tämä ominaisuus on erilainen jokaisella aineella.
Vaikka tässä tekstissä keskitytään fotoluminesenssiin, fotofysikaaliset prosessit ovat samat kaikentyyppisessä luminesenssissa.
Sovellukset
Fluoresenssia ja fosforesenssia hyödynnetään hehkutikkujen kaltaisten tuotteiden lisäksi monin muin tavoin. Muita esimerkkejä ovat hätäuloskäynnille johtavat opastuspylväät, jotka eivät tarvitse sähköä, mutta hehkuvat yöllä fosforesenssin ansiosta. Jopa kasveista voidaan tehdä fluoresoivia: Pinaattia voidaan muokata nanoteknologian avulla niin, että se pystyy havaitsemaan pohjavedessä olevat räjähdysainejäämät. Lehdet sisältävät hiilinanoputkia, joihin nitroaromaatit voivat sitoutua. Jos ne tekevät niin, kasvi vapauttaa fluoresoivan signaalin, joka voidaan havaita infrapunakameroilla .
Videolla esitellään erityyppistä luminesenssia. Vasemmalla näkyy kurkumamausteen sisältämän väriaineen kurkumiinin fluoresenssi UV-valossa . Kurkumiini liuotetaan alkoholiin, jotta fluoresenssi saadaan näkyviin.
Muovihämähäkki ja pienessä putkessa oleva yhdiste ovat esimerkkejä fosforesenssista. Strontiumaluminaatti, jota putki sisältää, innostuu aluksi UV-säteilystä ja emittoi lopulta vihreää valoa. Syynä tähän on seostaminen alkuaineilla, kuten europiumilla, joka tekee yhdisteestä käyttökelpoisen luminesenssipigmenttinä .
Hehkutikun taivuttaminen (oikealla) käynnistää kemiallisen reaktion vetyperoksidin ja väriaineen sekä fenyylioksalaatin välillä. Kemiluminesenssi voidaan havaita.
Video 1. Fluoresenssi, fosforesenssi ja kemiluminesenssi vertailussa.
K. Arnold et al., Chemie Oberstufe, Cornelsen Schulverlage, Berlin, 2015, 496-497. ISBN: 978-3-06-011179-4
Lexikon der Physik: Lumineszenz (saksaksi), spektrum.de. (accessed January 25, 2017)
D. Wiechoczek, Wenn Mineralien selber leuchten – Phosphoreszenz, Fluoreszenz und Lumineszenz (saksaksi), chemieunterricht.de 2010. (accessed January 25, 2017)
Lexikon der Physik: Photophysikalische Prozesse (saksaksi), spektrum.de. (accessed January 27, 2017)
D. Wiechoczek, Chemie mit Curry (saksaksi), chemieunterricht.de 2015. (accessed January 27, 2017)
P. W. Atkins, J. de Paula, Kurzlehrbuch Physikalische Chemie (saksaksi), Wiley-VCH, Weinheim, 2008, 853ff., 921ff. ISBN: 978-3-527-31807-0
P. W. Atkins, Physical Chemistry, Oxford University Press, 1994, 591ff.
Quantelung (saksaksi), chemie.de. (accessed January 27, 2017)
Bohrin taajuusyhteys (saksaksi), chemgapedia.de. (accessed January 25, 2017)
Ilmenau University of Technology, Practical Course Physical Chemistry II: Physical Chemistry/Microreaction Technology, Fluorescence Quenching Experiment (saksaksi), tu-ilmenau.de. (accessed January 27, 2017)
Stokes shift (saksaksi), chemie.de. (accessed January 25, 2017)
Elektronin spin (saksaksi), chemie.de. (viitattu 27.1.2017)
Quantum yield (saksaksi), chemie.de. (accessed January 27, 2017)
Pinaatti havaitsee räjähteitä pohjavedessä (saksaksi), Spiegel Online, 1. marraskuuta 2016. (accessed January 27, 2017)
D. Weiß, Phosphorescence (saksaksi), chemie.uni-jena.de. (viitattu 27. tammikuuta 2017)
 Kim Dreier on oppilas Marianne-Weber-Gymnasiumissa Lemgossa, Saksassa.
Kim Dreier on oppilas Marianne-Weber-Gymnasiumissa Lemgossa, Saksassa.