Introduction
Ihmisen aivot kypsyvät laajasti koko elämänsä ajan kognitiivisen kehityksen helpottamiseksi. Aksonien myelinisaatio koko hermostossa on yksi tällainen ratkaiseva kypsymisprosessi. Keskushermostossa (CNS) oligodendrosyyteiksi kutsutut gliasolut ulottavat monia prosesseja ympäröivään ympäristöönsä, jotka kietovat kalvoa keskittyneesti aksonien ympärille muodostaen myeliinitupet. Myeliinitupet mahdollistavat toimintapotentiaalien nopean suolaisen johtumisen lokalisoimalla jänniteohjatut Na+-kanavat vierekkäisten tuppien välisiin lyhyisiin aukkoihin (joita kutsutaan Ranvierin solmuiksi) ja toimimalla sähköisinä eristeinä. Aksonit, jotka ovat pitkin pituuttaan täysin myelinisoituneet, johtavat impulsseja moninkertaisesti nopeammin kuin poikkileikkaukseltaan samankokoiset myelinisoimattomat aksonit (Waxman, 1980). Siksi myelinisoituneet hermopiirit johtavat tietoa paljon nopeammin kuin myelinisoitumattomat piirit. Ihminen syntyy lähes myelinisoimattomana, ja oligodendrosyyttipopulaatio laajenee dramaattisesti syntymän jälkeen ja myelinisoituu laajalti ensimmäisten lapsuusvuosien aikana. Myelinisaatio jatkuu nuoruusiässä ja aikuisuudessa tyypillisellä spatiotemporaalisella tavalla, joka korreloi piirien asianmukaisen toiminnan syntymisen ja ylläpitämisen kanssa. Esimerkiksi valkoisen aineen (keskushermoston myeliinirikkaat alueet) kypsyminen on samanaikaista lapsuuden kognitiivisten prosessien, kuten tiedonkäsittelyn nopeuden, kehittymisen kanssa (Mabbott ym., 2006; Scantlebury ym., 2014). Lisäksi myeliinipatologiaa/epänormaaliuksia nähdään paitsi demyelinoivassa sairaudessa, multippeliskleroosissa, myös useissa neurodegeneratiivisissa sairauksissa (Kang ym., 2013; Huang ym., 2015) ja neurokehityshäiriöissä (Takahashi ym., 2011). Yksittäisten aksonien myelinisaatio ei kuitenkaan ole ”kaikki tai ei mitään” -ilmiö. Keskushermoston aksoneissa esiintyy laajaa vaihtelua myeliinitupen määrässä, tupen pituudessa, tupen paksuudessa ja jakautumisessa pituudeltaan. On olemassa monia erilaisia myelinisaatiomalleja; esimerkiksi nuorten ja aikuisten hiirten aivokuoressa on kuvattu aksoneita, joilla on harvakseltaan myelinisoituneita alueita (Tomassy et al., 2014; Hill et al., 2018; Hughes et al., 2018). Minkä tahansa näiden vaippaparametrien muuttamisella on ennustettavissa olevia vaikutuksia taustalla olevan aksonin johtumisnopeuteen – siksi tietyn myelinisaatiomallin määrittäminen aksonia pitkin voi olla erityisen tärkeää piirin toiminnan hienosäätämiseksi. Esimerkiksi gerbiilien kuuloaivorungon aksoneilla on distaalisia alueita pitkin asteittain lyhyemmät myeliinitupet, jotta varmistetaan signaalin saapumisen tarkka ajoitus äänen paikallistamisen helpottamiseksi (Ford et al., 2015). Hienovaraiset muutokset myelinisaation kokonaiskuviossa aksonia pitkin (joko uuden myeliinin lisäämisen tai olemassa olevan myeliinin uudelleenmuotoilun kautta) voivat muuttaa perusteellisesti hermoimpulssien ajoitusta virtapiireissä. Jos myeliini on sopeutumiskykyinen, tällaisten myelinisaatiokuvioiden muokkaaminen voi olla tehokas mekanismi, joka säätelee piirien toimintaa koko elämän ajan.
Uudet todisteet viittaavat siihen, että myeliini voi olla sopeutumiskykyinen vasteena piirien toimintaan. Koko aivojen diffuusiotensorikuvantamista voidaan käyttää mittaamaan laajoja muutoksia myeliinirikkaassa valkeassa aineessa ajan myötä – tällaiset kokeet ihmisillä ja jyrsijöillä ovat osoittaneet, että uuden tehtävän oppiminen korreloi valkean aineen muutosten kanssa asiaankuuluvilla aivoalueilla (Scholz et ai., 2009; Sampaio-Baptista et ai., 2013). Solutason analyysit eläinmalleissa osoittavat, että uusien myelinoivien oligodendrosyyttien tuotantoa tarvitaan tehokkaaseen motoriseen oppimiseen (McKenzie et al., 2014; Xiao et al., 2016). Tällä hetkellä oletetaan, että hermopiirin aktiivisuus voi laukaista muutoksia myeliinissä; laaja tutkimuskokonaisuus on osoittanut, että hermosolujen aktiivisuus voi vaikuttaa oligodendrosyyttien esisolujen (OPC) lisääntymiseen, oligodendrosyyttien erilaistumiseen sekä myeliinitupen muodostumiseen ja kasvuun. Tätä tutkimusta, mukaan lukien näyttöä siihen liittyvistä molekyylisistä signaaleista, on tarkasteltu laajasti muualla (Fields, 2015; Almeida ja Lyons, 2017; Mount ja Monje, 2017). Neuronaalinen aktiivisuus voisi ohjata myeliinin muutoksia, jotka puolestaan voisivat muuttaa johtumisnopeuksia piirien toiminnan perustana olevien ajoitusten hienosäätöä varten.
Me emme kuitenkaan vieläkään tiedä, sääteleekö piirien myelinisoitumista dynaamisesti koko elämän ajan tai miten. Jyrsijöillä tehdyt työt osoittavat, että uusia oligodendrosyyttejä syntyy koko keskushermostossa jopa aikuisuudessa (Young ym., 2013), ja ihmisen aikuisten aivoissa on OPC:tä (Chang ym., 2000). Ihmiskudoksen hiilidioksidiajoitusanalyysit ovat tunnistaneet aikuissyntyisiä oligodendrosyyttejä aivokuoren sisällä, vaikka samat analyysit osoittivat, että suurin osa aivokurkiaisen oligodendrosyyteistä on peräisin varhaislapsuudessa (Yeung ym., 2014). Ihmisillä tehdyt neurokuvantamistutkimukset, jotka korreloivat valkean aineen rakenteelliset muutokset tehtävän oppimisen kanssa, viittaavat kuitenkin siihen, että uutta myeliiniä voi muodostua koko elämän ajan. Tällainen pitkäkestoinen myelinisaatio edellyttäisi periaatteessa elinikäistä oligodendrosyyttien tuotantoa, koska yksittäisillä myelinoivilla oligodendrosyyteillä on vain muutaman tunnin rajoitettu aikaikkuna uusien vaippojen muodostumisen aloittamiseksi (Watkins ym., 2008; Czopka ym., 2013) ja vaippojen määrä oligodendrosyyttiä kohti näyttää pysyvän vakaana ajan myötä (Tripathi ym., 2017). Yksi Mountin ja Monjen (2017) huomioima varoitus on se, että hiilidatointikokeen ”syntymäaika” (joka määrittää DNA:n replikaation ajankohdan solunjakautumisen aikana) heijastaa OPC:n, ei välttämättä erilaistuneen oligodendrosyytin, syntymäaikaa. Tämä on tärkeää, kun otetaan huomioon todisteet siitä, että OPC:t voivat ainakin jyrsijöillä erilaistua suoraan oligodendrosyyteiksi ilman solunjakautumista (Hughes ym., 2013). Corpus callosumissa olevat OPC:t saattoivat erilaistua suoraan oligodendrosyyteiksi monta vuotta päätteellisen solunjakautumisensa jälkeen; näin ollen näiden uusien oligodendrosyyttien erilaistumisajankohtaa ei voida määrittää hiilidioksidiajoituksella, joten Yeung ym. (2014) ovat saattaneet aliarvioida oligodendrosyyttien tuotantonopeuden aikuisen ihmisen aivoissa. Meillä on vielä paljon opittavaa oligodendrosyyttien synnyn ja myeliinin uudelleenmuodostuksen suhteellisesta osuudesta keskushermoston kehitykseen koko elämän ajan.
Jotta voisimme täysin ymmärtää oligodendrogeneesin, myeliinin muodostumisen ja myeliinin uudelleenmuodostuksen tarkan dynamiikan eri elämänvaiheissa, pitkittäisleikkauskuvaus korkealla resoluutiolla edustaa kultaista standardia. Tässä esitämme yleiskatsauksen viimeaikaisista in vivo -kuvantamistutkimuksista, jotka alkavat selventää myelinisaation dynamiikkaa, minkä ansiosta voimme myös alkaa ymmärtää, miten tällainen dynamiikka saattaa vaikuttaa hermopiirien toimintaan.
De novo myelinisaatio
Aloittaaksemme lopullisen selvityksen siitä, miten oligodendrosyytit syntyvät ja miten myeliiniä muodostuu ja miten sitä dynaamisesti remoduloituu in vivo, kahdessa viimeaikaisessa tutkimuksessa käytettiin hiiren somatosensorisen aivokuoren toistuvaa kahden fotonin kuvantamismenetelmää pitkien ajanjaksojen ajan. Hughes ym. (2018) kuvasivat transgeenisten reportterihiirien aivokuorta, jossa oli fluoresoivasti leimattuja oligodendroglialisen linjan soluja varhaisesta aikuisuudesta keski- ja vanhuuteen (noin P720) asti. He havaitsivat, että oligodendrosyyttipopulaatio laajenee edelleen ja että aivokuoren oligodendrosyyttitiheys lähes kaksinkertaistuu nuoren aikuisen ja keski-ikäisen vaiheen välillä (kuva 1A). Tähän liittyi aivokuoren myeliinitupien määrän yli kaksinkertaistuminen. Mutta miten oligodendrosyyttien määrä kasvaa? Varhaisessa postnataalisessa kehityksessä syntyy paljon oligodendrosyyttejä, mutta vain osa niistä jää eloon ja jatkaa aksonien myelinisoimista (Barres ym., 1992). Tämä näyttää olevan samanlaista aikuisuudessa – seuraamalla yksittäisiä kortikaalisia OPC-soluja aikuisen aivokuoressa jopa 50 päivän ajan Hughes et al. (2018) paljastivat, että suurin osa vastikään erilaistuneista oligodendrosyyteistä kokee solukuoleman, ja vain 22 prosenttia selviytyy ja sitoutuu myelinisaatioon (kuva 1B). Vielä ei tiedetä, mikä osuus vasta erilaistuneista oligodendrosyyteistä syntyy OPC:n jakautumisen jälkeen verrattuna suoraan erilaistumiseen. Kun oligodendrosyytit ovat sitoutuneet myelinisaatioon, ne pysyvät kuitenkin vakaina, eikä myelinisoituvien oligodendrosyyttien solukuolemasta ole viitteitä 50 päivän kuvausjakson aikana.
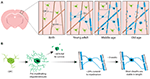
KUVIO 1. Oligodendrosyyttien solukuolema. Oligodendrosyyttien ja myeliinin dynamiikka nisäkkäiden aivokuoressa koko elämän ajan. (A) Oligodendrosyyttien esisolut (OPC) tuottavat jatkuvasti uusia myelinoivia oligodendrosyyttejä (OL) somatosensorisessa aivokuoressa syntymästä keski-ikään asti. OL-populaatio vähenee sitten vanhuudessa, mihin liittyy myeliinin peittävyyden väheneminen. (B) Yksittäisten OPC-solujen linjanseuranta osoittaa, että vaikka premyelinoivia OL-soluja tuotetaan jatkuvasti aikuisiässä, vain noin 20 prosenttia niistä selviytyy myelinisoitumaan. Suurin osa muodostuneista myeliinitupista pysyy pituudeltaan vakaana pitkän ajanjakson ajan, mikä osoittaa, että olemassa olevan myeliinin uudelleenmuodostus on yleensä hyvin vähäistä. Yhteenveto Hill ym. (2018) ja Hughes ym. (2018) tiedoista.
Hill ym. (2018) käyttivät vastaavasti oligodendrosyyttien transgeenisiä reporttereita ja merkkausvapaata spektraalista konfokaalista reflektanssitekniikkaa (SCoRe) kuvaamaan myeliiniä aksonien varrella (Schain ym., 2014) nuoruusikäisten, nuorten aikuisten, keski-ikäisten ja vanhojen hiirten somatosensorisessa aivokuoressa (P950). He havaitsivat myös, että oligodendrosyyttien määrä jatkaa kasvuaan aikuisiässä aina P650:een asti ja että oligodendrosyytit ovat vakaita keski-iässä jopa 80 kuvauspäivän ajan. He havaitsivat, että aivokuoren myelinisaatio on myös huipussaan keski-iässä P650:ssä ja että oligodendrosyyttitiheys laskee merkittävästi huipusta (P650:ssä) hyvin vanhuuteen (P950) asti (kuva 1A). Tämä näkyi aivokuoren kerroksen I aksonien myeliinipeitteen vähenemisenä P650:n ja P950:n välillä. Pitkän aikavälin oligodendrosyyttien eloonjääminen voi vaihdella keskushermoston eri osien välillä. Tripathi ym. (2017) leimasivat myelinoivia oligodendrosyyttejä hiirillä P60:ssä ja laskivat sitten, kuinka monta leimattua solua säilyi hengissä P605:een asti useilla CNS-alueilla. He havaitsivat, että selkäytimessä ja motorisella aivokuorella 60-70 % P60-merkityistä soluista selvisi hengissä, kun taas corpus callosumissa yli 90 % P60-merkityistä soluista selvisi hengissä. Oligodendrosyyttien määrän ja myelinisaation väheneminen tietyillä keskushermoston alueilla iän myötä herättää kiehtovia kysymyksiä myeliinikadon merkityksestä ikään liittyvässä kognitiivisessa heikkenemisessä. Magneettikuvausanalyysi osoittaa, että valkean aineen mikrorakenne korreloi nestemäisen älykkyyden kanssa (Ritchie ym., 2015), mutta myös, että tämä valkean aineen mikrorakenne heikkenee iän myötä (Cox ym., 2016). Myöhemmin ikään liittyvä myeliinikato voisi johtaa kognitiivisten toimintojen heikkenemiseen myeliinipiirien säätelyhäiriöiden vuoksi.
Voisiko uusien oligodendrosyyttien (ja sen jälkeen uuden myeliinin) muodostuminen aikuisten aivokuoressa reagoida piirien toimintaan? Aiemmat tutkimukset ovat osoittaneet, että sensorisen tulon vähentäminen poistamalla hiiriltä viikset johtaa vähentyneeseen oligodendrogeneesiin somatosensorisella aivokuorella (Hill ym., 2014). Tutkiakseen tätä tarkemmin Hughes et al. (2018) tarjosi aikuisille (P365) hiirille aistiärsykettä 3 viikon ajan ripustamalla helmiä eläinten häkkeihin stimuloimaan toistuvasti niiden viiksiä ja siten somatosensorista aivokuorta. Kuvantamalla somatosensorista aivokuorta ennen 3 viikkoa ja sen jälkeen he osoittivat, että sensorinen stimulaatio lisää oligodendrosyyttien lukumäärää, mikä saattaa johtua äskettäin erilaistuneiden solujen lisääntyneestä selviytymisestä. Kougioumtzidou et al. (2017) antoivat lisätodisteita siitä, että piirien aktiivisuus voi olla tärkeää solujen selviytymisen säätelyssä – he osoittivat, että AMPA-reseptorin alayksiköiden 2, 3 ja 4 menetys OPC:ssä johtaa oligodendrosyyttien selviytymisen vähenemiseen. Tämä viittaa siihen, että de novo myelinisaatiota voitaisiin muokata aivokuoren piirien aktiivisuudella koko elämän ajan, ehkäpä näiden samojen piirien toiminnan hienosäätämiseksi.
Monia kysymyksiä on vielä ratkaisematta: mikä on oligodendrogeneesin ja uuden myelinisaation vaikutus piirien todelliseen toimintaan? Parantaako neuronaalinen aktiivisuus myelinoivien oligodendrosyyttien pitkäaikaista selviytymistä? On mahdollista, että oligodendrosyyttien häviäminen vanhuudessa johtuu ikään liittyvästä hermosolujen aktiivisuuden vähenemisestä, mikä puolestaan saattaa vaikuttaa oligodendrosyyttien yleiseen selviytymiseen. Vaihtoehtoisesti voi olla, että oligodendrosyyttien elinikä on rajoitettu neuronaalisesta aktiivisuudesta riippumatta (joko sisäisesti ohjelmoituna tai muiden ikääntymiseen liittyvien ulkoisten signaalien vaikutuksesta). Kummassakin tapauksessa piirin stimulaatio voisi auttaa lievittämään ikään liittyvää myeliinikatoa joko edistämällä olemassa olevien oligodendrosyyttien selviytymistä tai stimuloimalla uusien oligodendrosyyttien tuotantoa. Tällä puolestaan voisi olla merkittäviä vaikutuksia ikään liittyvän kognitiivisen heikkenemisen hoidossa ja ennaltaehkäisyssä.
Aktiivisuusvälitteinen oligodendrogeneesi ei rajoitu vain somatosensoriseen aivokuoreen – motorista oppimista suorittavilla nuorilla aikuisilla hiirillä on havaittavissa myös uusien erilaistuneiden oligodendrosyyttien lukumäärän lisääntymistä motorisella aivokuorella (Xiao ym., 2016). Entä muut keskushermoston alueet? Monet kortikaaliset aksonit projisoituvat corpus callosumin kautta, ja siksi kortikaalisten piirien stimulaatio voisi antaa signaalin sekä kortikaalisille että callosaalisille OPC:ille. Kaksi jyrsijöillä tehtyä tutkimusta on osoittanut, että kortikaalisten neuronien stimulaatio indusoi oligodendrogeneesin corpus callosumissa. Gibson et al. (2014) stimuloivat optogeneettisesti kerroksen V projektioneuroneja premotorisella aivokuorella ja havaitsivat OPC-proliferaation lisääntyvän sekä premotorisella aivokuorella että corpus callosumissa. Tämä johti oligodendrosyyttien määrän ja vaipan paksuuden lisääntymiseen 4 viikkoa stimulaation jälkeen. Äskettäin Mitew et al. (2018) käyttivät Designer Receptors Exclusively Activated by Designer Drugs -teknologiaa stimuloidakseen kerroksen 2/3 somatosensorisia neuroneja ja havaitsivat myös lisääntynyttä OPC-proliferaatiota, oligodendrogeneesiä ja paksumpia myeliinituppeja corpus callosumissa sekä nuorilla että aikuisilla hiirillä. He osoittivat myös, että uudet oligodendrosyytit muodostavat myeliinituppeja ensisijaisesti aktiivisten aksonien päälle. Tämä osoittaa, että aktiivisuuden aiheuttama de novo -myelinisaatio voi periaatteessa kohdistua aktiivisiin aksoneihin/piireihin. Vielä ei tiedetä, kuinka pitkäkestoisia myeliinin muutokset hermosolujen aktiivisuuden seurauksena voivat olla. Tripathin ym. (2017), Hillin ym. (2018) ja Hughesin ym. (2018) havaitsema myelinoivien solujen pitkäaikainen eloonjääminen viittaa siihen, että kun oligodendrosyytti on kerran muodostanut myeliinitupet, se todennäköisesti säilyy hengissä, vaikka neuronaalinen aktiivisuustaso palaisi takaisin perustasolle. Se, muuttuvatko itse myeliinitupet, kun neuronaalinen aktiivisuus palaa normaalitasolle, vaatii lisää tutkimusta yksittäisten tupien dynamiikasta, jota käsitellään jäljempänä.
Siten on mahdollista, että elinikäistä de novo -myelinisaatiota tapahtuu monilla keskushermoston alueilla, joilla myelinisaatioon soveltuvilla aksoneilla on riittävästi myelinisoitumatonta tilaa. On kuitenkin edelleen epäselvää, missä määrin oligodendrogeneesi jatkuu aikuisen ihmisen aivojen eri alueilla. Hiiliajoitusanalyysi viittaa siihen, että useimmat oligodendrosyytit corpus callosum -radalla syntyvät varhaislapsuudessa (Yeung ym., 2014). Ihmisen aivokudoksen immunohistokemiallinen analyysi, jossa käytetään uutta vasta erilaistuneiden oligodendrosyyttien merkkiainetta (BCAS1), osoittaa uusia oligodendrosyyttejä otsalohkossa jopa keski-ikää pidemmälle, mutta hyvin vähän uusia oligodendrosyyttejä valkeassa aineessa kolmannen elinvuosikymmenen jälkeen (Fard ym., 2017). Tämä ero oligodendrogeneesissä lajien välillä voi johtua mittakaavasta. Hughesin ym. (2013) jyrsijöiden tiedot viittaavat siihen, että oligodendrosyyttejä syntyy valtavasti liikaa, ja lähes 80 % soluista karsitaan jatkuvasti. Kun otetaan huomioon tällaisen prosessin energiakustannukset, onko tämä mekanismi kestävä koko elämän ajan ihmisen aivojen kokoisessa elimessä? Ehkä ihmisen aivoissa oligodendrosyyttien ylituotanto on rajallista, koska suuremman keskushermoston myelinisaatio on pitkäkestoisempaa tai koska signaalit, kuten hermosolujen aktiivisuus, stimuloivat OPC-soluja erilaistumaan oligodendrosyyteiksi tarpeen mukaan.
Myeliinin uudelleenmuokkaus
Olemassa olevien myeliinitupien uudelleenmuokkaus voisi muuttaa johtumisominaisuuksia ilman, että olisi tarpeen synnyttää uusia oligodendrosyyttejä tai myeliinia. Olemassa olevien myeliinituppien pituuden muuttaminen voisi muuttaa myeliinin peittävyyttä aksonia pitkin ja Ranvierin solmujen välistä etäisyyttä (jotka molemmat vaikuttaisivat johtumisnopeuksiin). Lisäksi hyvin hienovarainenkin myeliinin uudelleenmuokkaus voisi muuttaa itse solmujen pituuksia. Äskettäin on osoitettu, että solmujen pituus voi vaihdella laajasti näköhermossa ja aivokuoressa, ja että solmujen pituuksien muuttaminen aksonia pitkin voi periaatteessa muuttaa merkittävästi myös johtumisnopeutta (Arancibia-Cárcamo ym., 2017). Se, johtuvatko Ranvierin solmun muutokset ensisijaisesti myelinisaatiosta vai itse aksonin uudelleenorganisoitumisesta, on vielä selvittämättä.
Kumpikin Hill et al. (2018) ja Hughes et al. (2018) suorittivat pitkittäistutkimuksen yksittäisistä myeliinitupista hiiren somatosensorisessa aivokuoressa useiden viikkojen ajan sen arvioimiseksi, säätelevätkö tuppien pituudet dynaamisesti. Hill et al. (2018) havaitsivat, että varhaisessa aikuisuudessa (P90-120), vaikka joillakin tupilla esiintyy pidentymistä tai kutistumista, 81 % havaituista tupista oli vakaita. Useammat tupet saattavat muuttua pituudeltaan vakaiksi iän myötä; Hughes ym. (2018) seurasivat vanhempien (P365) eläinten tupia ja havaitsivat, että 99 % tupista pysyi vakaana kolmen viikon ajan (kuva 1B).
Samankaltaista tupen pituuden pysyvyyttä on kuvattu myös muualla; Auer ym. (2018) käyttivät toukkavaiheessa olevaa seeprakalaa tutkiakseen, voivatko yksittäiset tupet muuttua pituuksiltaan ajan mittaan suorittamalla fluoresenssilla leimattujen myeliinitupien aikakulkua koskevaa elävää kuvausta. He havaitsivat, että yksittäiset tupet kasvavat nopeasti mutta vaihtelevasti ensimmäisinä päivinä muodostumisen jälkeen, ennen kuin tupen pituus vakiintuu. Kun tuppien pituus on vakiintunut, ne jatkavat kasvuaan vain eläimen kokonaiskasvun mukaisesti.
Miksi joidenkin aivokuoren tuppien pituus muuttuu, kun taas toisten ei? Tämä saattaa heijastaa erilaisten hermopiirien vaatimusten erilaisuutta. Aksonien monimuotoisuutta on havaittu myelinisaation alkuvaiheessa seeprakalojen selkäytimessä, jossa jotkin aksonit käyttävät synaptisten vesikkelien vapautumista myeliinitupen määrän ja pituuden säätelyyn, kun taas toiset eivät (Koudelka ym., 2016). Tämä herättää kiehtovan hypoteesin, että vain jotkut aksonit kykenevät säätelemään myeliiniä aktiivisuuteen liittyvien signaalien avulla. Hughes et al. (2018) havaitsivat, että heidän sensorinen stimulaatioparadigmansa ei lisännyt dynaamisten tupien osuutta somatosensorisessa aivokuoressa. Aksonien alatyyppien monimuotoisuuden yksityiskohtaisempi analyysi yhdistettynä tuppien pituuden dynamiikan pitkittäistutkimukseen voisi kuitenkin vahvistaa, onko tuppien pituuden uudelleenmallinnus spesifistä tietyille piireille.
Kuvastaako tuppien pituuden vakaus tuppien kyvyttömyyttä uudelleenmallinnukseen? Seeprakalalla tehdyt kokeet viittaavat siihen, että vaipan pituuden uudelleenmuodostus voidaan käynnistää, kun aksonin myelinisaatioprofiili häiriintyy. Auer ym. (2018) ablatoivat yksittäisiä oligodendrosyyttejä ja poistivat siten harvakseltaan tuppeja pitkin aksoneja. He havaitsivat, että kun yksittäinen myeliinituppi häviää täysin myelinoidusta aksonista, viereiset tupet voivat aloittaa uudelleen nopean kasvun peittääkseen myelinoimattoman aukon. Useissa tapauksissa uusi myeliinituppi muodostui edeltäjänsä tilalle ja saattoi jopa työntyä sisään tunkeutuvia naapuritupia vastaan palauttaakseen myelinisaation alkuperäisen mallin (kuva 2A). Joskus siis tietty myelinisaatiokuvio säilyy ensisijaisesti myös myeliinin katkeamisen jälkeen. Tämä voi johtua taustalla olevan aksonin optimoitujen johtumisominaisuuksien ylläpitämisestä. Auer ym. (2018) havaitsivat seeprakalan toukassa harvakseltaan myelinisoituneita aksoneja, kuten aiemmin on havaittu jyrsijöiden aivokuoressa. Mielenkiintoista oli, että kun tällaisten harvaan myelinisoituneiden aksonien yksittäisiä vaippoja abloitiin, uusi vaippa muodostui käytännöllisesti katsoen samaan paikkaan kuin abloitunut vaippa, jopa muuten myelinisoitumatonta aksonijaksoa pitkin (kuva 2B). Näin ollen myelinisaatiokuviot harvaan myelinisoituneiden aksonien varrella näyttävät säilyvän vakaasti myös seeprakaloissa, kuten Hill ym. (2018) jyrsijöillä ehdottivat. Harvojen myelinisaatioprofiilien funktio on edelleen tuntematon. Tällaiset kuviot saattavat mahdollistaa yksittäisten aksonien toiminnan dynaamisemman hienosäädön ajan myötä, vaikka on myös mahdollista, että tällaiset myelinoimattomat aukot voivat helpottaa asteittaista myelinisaatiota johdonmukaisten johtumisaikojen ylläpitämiseksi virtapiirien sisällä eläimen kasvaessa ja/tai aksonien pituuksien muuttuessa.
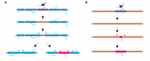
KUVIO 2. Myelinoimattomat aukkokohdat. Myeliinin uudelleenmuodostusta voi tapahtua in vivo. (A) Täysin myelinisoituneen aksonin yksittäisten vaippojen ablaatio voi saada aikaan viereisten vaippojen nopean kasvun kattamaan aukon. Naapuritupet voivat joko peittää aukon kokonaan tai alkuperäinen myelinisaatioprofiili voidaan palauttaa lisäämällä uusi tuppi. (B) Harvaan myelinisoituneen aksonin vaipan poistamista seuraa uuden myeliinitupen muodostuminen, joka on kooltaan ja sijainniltaan identtinen poistetun edeltäjätupen kanssa. Yhteenveto Auerin ym. (2018) tiedoista.
Onko myös nisäkkäiden stabiileilla myeliinitupilla tämä kyky uudelleenmuodostua, kun myelinisaatiomalli häiriintyy? Tähän kysymykseen vastaamiseksi tarvitaan lisää pitkittäistutkimuksia yhdistettynä demyelinisaatioon. On mahdollista, että hermosolujen toiminta ei aiheuta tällaista uudelleenmuodostumista, vaan se on myeliinikatoa kompensoiva mekanismi. Ikään liittyvä oligodendrosyyttikato voisi käynnistää eloonjääneiden vaippojen uudelleenmuodostuksen, joka peittäisi aksonin poistuneet osat ja auttaisi siten ylläpitämään piirin toimintaa. Myeliinitupien elävällä kuvantamisella vanhuudessa voitaisiin selvittää, onko näin.
Tässä käsitellyissä elävällä kuvantamisella tehdyissä tutkimuksissa on kaikissa arvioitu myeliinitupen pituuden dynamiikkaa, mutta ei myeliinitupen paksuutta. Voiko vaipan paksuutta säädellä dynaamisesti? PI3K/AKT/mTOR-signaloinnin stimulointi aikuisten hiirten oligodendrosyyteissä laukaisee lisämyeliinikääreiden kietoutumisen tupen paksuuden lisäämiseksi (Snaidero ym., 2014). Tätä voi moduloida piirin aktiivisuus, sillä neuronaalinen stimulaatio johtaa vaipan paksuuden lisääntymiseen sekä nuorilla että aikuisilla hiirillä (Gibson et al., 2014; Mitew et al., 2018). Tämä korostaa tarvetta kuvata kaikkia vaippaparametreja pitkittäissuunnassa, jotta vaipan uudelleenmuodostuksen dynamiikkaa voidaan täysin ymmärtää. Tarvitaan eläviä kuvantamismenetelmiä, joilla voidaan mitata tarkasti vaipan paksuus aksoneita pitkin, sillä tällä hetkellä tämä edellyttää poikkileikkausmittausta elektronimikroskopian avulla, mikä rajoittaa analyysin yhteen aikapisteeseen. Jotkin leimattomat kuvantamistekniikat, kuten kolmannen harmonisen sukupolven mikroskopia ja spektraalinen reflektometria, ovat lupaavia tällaisten mittausten suorittamiseksi (Lim ym., 2014; Kwon ym., 2017). Näiden tekniikoiden yhdistäminen jyrsijöiden aivokuoren pitkittäistutkimuksiin voisi määrittää, voivatko vakiintuneet myeliinitupet säätää paksuuttaan vai työntääkö neuronaalinen aktiivisuus yksinkertaisesti de novo myelinisaatiota tuottamaan paksumpia tuppeja.
Näyttää siis siltä, että vaikka myeliinitupet pystyvät muokkautumaan uudelleen myeliinin häiriintyessä, suurin osa tupeista on yleensä pituudeltaan vakaita. Tämä vakaus johtuu mahdollisesti varhain vakiintuneiden, piirin toiminnan kannalta optimoitujen myelinisaatiomallien ylläpitämisestä.
Tulevaisuus
Nisäkkäiden viimeaikaisissa kuvantamistutkimuksissa on keskitytty de novo -myelinisaatioon ja vaippojen uudelleenmuodostukseen aivokuoren harmaassa aineessa. Aivokuoren piirit vastaanottavat ja lähettävät tietoa monien alueiden, kuten selkäytimen ja corpus callosumin, kautta, joten myeliinin muutokset useilla eri keskushermoston alueilla voivat muuttaa signalointia yhdessä piirissä. Keskushermostoa on perinteisesti kuvattu sen mukaan, miltä se näyttää formaldehydikiinnityksen jälkeen, jolloin ”valkoinen aine” kuvaa voimakkaasti myelinisoituneita aksoniratoja, kun taas ”harmaa aine” kuvaa alueita, jotka ovat täynnä hermosolujen soluelimiä, dendriittejä ja synapseja. Tämä luokittelu on kuitenkin liian yksinkertaistettu; OPC:t tuottavat myelinoivia oligodendrosyyttejä sekä harmaassa että valkoisessa aineessa (Dawson ym., 2003), ja itse asiassa oligodendroglialisen linjan monimuotoisuudesta ja myelinisaatiomalleista sekä harmaassa että valkoisessa aineessa on nousemassa näyttöä (Rivers ym., 2008; Viganò ym., 2013; Young ym., 2013; Bechler ym., 2015). Tällainen monimuotoisuus saattaa heijastaa myeliinin ainutlaatuisia vaatimuksia CNS:n eri alueilla ja mahdollisesti eri piireissä. Tarvitaan lisää pitkittäisiä kuvantamistutkimuksia, jotta voidaan ymmärtää paremmin de novo -myelinisaation ja vaipan uudelleenmuodostuksen dynamiikkaa aivokuoren ulkopuolisilla CNS:n alueilla.
Vaikka toukkavaiheen seeprakalan optinen läpinäkyvyys soveltuu ei-invasiiviseen elävään kuvantamiseen, tällaisten kokeiden suorittaminen nisäkkäiden CNS:ssä on invasiivisempaa ja teknisesti haastavampaa. Hill ym. (2018) ja Hughes ym. (2018) hyödynsivät kaksifotonimikroskopiaa kraniaalisilla kuvausikkunoilla kuvatakseen jopa 400 μm:n syvyydeltä aivokuorta. Samanlaisia tekniikoita voitaisiin käyttää selkäytimen pinnallisten myelinoituneiden ratojen kuvaamiseen ajan kuluessa (Locatelli ym., 2018), mutta syvemmille keskushermoston alueille ei voida tunkeutua pelkällä kaksifotonimikroskopialla. Yksi vaihtoehto on käyttää kaksifotonimikroendoskopiaa, jossa gradienttitaitekerroinlinssillä (GRIN) varustettu mikroendoskooppisondi työnnetään kudoksen sisään, jotta voidaan kuvata soluja syvemmällä aivoissa . Endoskoopin asettaminen voi kuitenkin aiheuttaa tulehdusreaktioita, jotka voivat vaikuttaa myelinisaatioon. Vaihtoehtona voisi olla kolmifotonimikroskopia käyttäen kraniaalista kuvausikkunamenetelmää, jota on aiemmin käytetty myös hippokampuksen kuvaamiseen (Horton ym., 2013; Ouzounov ym., 2017). Kolmen fotonin mikroskopialla saadaan huomattavasti parempi signaali-taustasuhde kuin kahden fotonin mikroskopialla, joten sillä voidaan kuvata syvempiä kudosrakenteita.
Erityisen tärkeää on huomioida paitsi erilaiset keskushermoston alueet, myös erilaiset neuronit näillä alueilla. Aiemmat tutkimukset viittaavat siihen, että on olemassa mekanistisia eroja siinä, miten eri neuronien alatyypit säätelevät myelinisaatiotaan (Koudelka ym., 2016). Lisäksi myeliinin paikallisessa säätelyssä voi olla monimuotoisuutta. On tärkeää muistaa, että keskushermoston eri osat eivät ole erillisiä kokonaisuuksia, vaan ne ovat yhteydessä toisiinsa. Mesoskaalisen konnektomiikan integrointi, joka keskittyy ymmärtämään eri hermosolujen alatyyppien yhteyksiä eri alueilla (Zeng, 2018), on ratkaisevan tärkeää ymmärtäessämme, miten elinikäisen myelinisaation dynamiikka vaihtelee eri piirien välillä.
Mikä on myeliinin säätelyn toiminnallinen seuraus pitkin eri piirejä? Toistaiseksi toiminnalliset seuraukset voidaan päätellä vain korrelaatioiden perusteella käyttäytymisen kanssa. Viime kädessä on tarpeen yhdistää myeliinin dynamiikan mittaaminen piirien toiminnan suoraan arviointiin. Tämä edellyttää hermosolujen aktiivisuuden rekisteröintiä myelinisaation pitkittäistutkimusten aikana, jotta havaittu de novo -myelinisaatio tai vaipan uudelleenmuodostus voidaan yhdistää suoraan piirin toiminnassa ajan myötä tapahtuviin muutoksiin. On tärkeää mitata yksittäisten neuronien ja aksonien myeliinidynamiikkaa ja elektrofysiologista aktiivisuutta, jotta voidaan määrittää, miten eri myeliinitupen parametrien muutokset todella vaikuttavat johtumisominaisuuksiin yksittäisen solun tasolla, sekä arvioida aktiivisuutta populaatiotasolla. Työkalut, kuten geneettisesti koodatut Ca2+- tai jänniteindikaattorit, mahdollistavat piirin aktiivisuuden suhteellisen ei-invasiivisen tallentamisen, ja niitä voidaan käyttää jopa koko aivojen piirin aktiivisuuden arvioimiseen (Ahrens ym., 2012; Lovett-Barron ym., 2017).
Johtopäätös
Aksonien myelinisoituminen edustaa voimakasta potentiaalista mekanismia, jonka avulla voidaan säädellä piirin toimintaa läpi elämän. Tutkimukset ovat osoittaneet, että de novo myelinisaatiota aivokuorella (uusien oligodendrosyyttien tuotannon kautta) tapahtuu jopa aikuisuudessa ja että sitä voidaan tehostaa stimuloimalla piirin toimintaa. Kun myeliini on muodostunut, se on vakaa, sillä oligodendrosyyttien vaihtuvuus on vähäistä ja olemassa olevien myeliinitupien pituudet muuttuvat vain vähän. Nämä vakaat rakenteet voivat kuitenkin säilyttää kyvyn muokkautua uudelleen, jos myeliini häiriintyy. Tällä on mielenkiintoisia vaikutuksia myeliinin plastisuuteen piirin toiminnan ylläpitämisessä vammojen, sairauksien ja vanhuuden aikana. Jää nähtäväksi, miten myelinisaatiossa tapahtuvat muutokset vaikuttavat taustalla olevan piirin toimintaan. Viime kädessä tarvitaan piiritason lähestymistapa, jossa myeliinin dynamiikan analyysi yhdistetään piirin toiminnan suoriin mittauksiin, jotta voidaan täysin ymmärtää, miten dynaaminen myelinisaatio vaikuttaa hermoston kokonaistoimintaan koko eliniän ajan.
Tekijöiden panos
Kaikki luetellut kirjoittajat ovat antaneet merkittävän, välittömän ja älyllisen panoksen työhön ja hyväksyneet sen julkaistavaksi.
Rahoitus
DAL:ia tuetaan Wellcome Trustin vanhempien tutkijoiden apurahalla (Wellcome Trust Senior Research Fellowship (102836/Z/13/Z). JMW:tä tukee Edinburghin yliopiston tohtorikoulutuksen Tissue Repair Studentship Award (MRC Doctoral Training Partnership MR/K501293/1) ja Wellcome Trustin nelivuotinen tohtorikoulutusohjelma Tissue Repair (Grant 108906/Z/15/Z).
Conflict of Interest Statement
Tekijät ilmoittavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdolliseksi eturistiriidaksi.
Ahrens, M. B., Li, J. M., Orger, M. B., Robson, D. N., Schier, A. F., Engert, F., et al. (2012). Aivojen laajuinen neuronidynamiikka motorisen sopeutumisen aikana seeprakalassa. Nature 485, 471-477. doi: 10.1038/nature11057
PubMed Abstract | CrossRef Full Text | Google Scholar
Almeida, R. G., and Lyons, D. A. (2017). Myelinoidun aksonin plastisuudesta ja hermopiirin muodostumisesta ja toiminnasta. J. Neurosci. 37, 10023-10034. doi: 10.1523/JNEUROSCI.3185-16.2017
CrossRef Full Text | Google Scholar
Arancibia-Cárcamo, I. L., Ford, M. C., Cossell, L., Ishida, K., Tohyama, K. ja Attwell, D. (2017). Node of Ranvier length as a potential regulator of myelinated axon conduction speed. eLife 6:e23329. doi: 10.7554/eLife.23329
PubMed Abstract | CrossRef Full Text | Google Scholar
Auer, F., Vagionitis, S., and Czopka, T. (2018). Todisteet myeliinitupen uudelleenmuotoilusta keskushermostossa, joka paljastuu in vivo -kuvantamisella. Curr. Biol. 28, 549-559. doi: 10.1016/j.cub.2018.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Barres, B. A., Hart, I. K., Coles, H. S. R., Burne, J. F., Voyvodic, J. T., Richardson, W. D., et al. (1992). Solukuolema ja solujen selviytymisen hallinta oligodendrosyyttilinjassa. Cell 70, 31-46. doi: 10.1016/0092-8674(92)90531-G
CrossRef Full Text | Google Scholar
Bechler, M. E., Byrne, L., and Ffrench-Constant, C. (2015). CNS:n myeliinitupen pituudet ovat oligodendrosyyttien luontainen ominaisuus. Curr. Biol. 25, 2411-2416. doi: 10.1016/j.cub.2015.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, A., Nishiyama, A., Peterson, J., Prineas, J., ja Trapp, B. D. (2000). NG2-positiiviset oligodendrosyyttien esisolut aikuisen ihmisen aivoissa ja multippeliskleroosin vaurioissa. J. Neurosci. 20, 6404-6412. doi: 10.1523/JNEUROSCI.20-17-06404.2000
PubMed Abstract | CrossRef Full Text | Google Scholar
Cox, S. R., Ritchie, S. J., Tucker-Drob, E. M., Liewald, D. C., Hagenaars, S. P., Davies, G., ym. et al. (2016). Ikääntyminen ja aivojen valkean aineen rakenne 3513 UK Biobank -osallistujalla. Nat. Commun. 7:13629. doi: 10.1038/ncomms13629
PubMed Abstract | CrossRef Full Text | Google Scholar
Czopka, T., Ffrench-Constant, C., and Lyons, D. A. (2013). Yksittäisillä oligodendrosyyteillä on vain muutama tunti aikaa tuottaa uusia myeliinituppeja in vivo. Dev. Cell 25, 599-609. doi: 10.1016/j.devcel.2013.05.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Dawson, M. R. L., Polito, A., Levine, J. M. ja Reynolds, R. (2003). NG2:ta ilmentävät glial progenitor-solut: runsas ja laajalle levinnyt kiertävien solujen populaatio aikuisen rotan CNS:ssä. Mol. Cell. Neurosci. 24, 476-488. doi: 10.1016/S1044-7431(03)00210-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Fard, M. K., Van der Meer, F., Sánchez, P., Cantuti-Castelvetri, L., Mandad, S., Jäkel, S., et al. (2017). BCAS1-ekspressio määrittelee varhaisten myelinoivien oligodendrosyyttien populaation multippeliskleroosin leesioissa. Sci. Transl. Med. 9:eaam7816. doi: 10.1126/scitranslmed.aam7816
PubMed Abstract | CrossRef Full Text | Google Scholar
Fields, R. D. (2015). Uusi hermoston plastisuuden mekanismi: aktiivisuudesta riippuvainen myelinisaatio. Nat. Rev. Neurosci. 16, 756-767. doi: 10.1038/nrn4023
PubMed Abstract | CrossRef Full Text | Google Scholar
Ford, M. C., Alexandrova, O., Cossell, L., Stange-Marten, A., Sinclair, J., Kopp-Scheinpflug, C., et al. (2015). Ranvierin solmun ja internodien ominaisuuksien virittäminen myelinoiduissa aksoneissa toimintapotentiaalien ajoituksen säätämiseksi. Nat. Commun. 6:8073. doi: 10.1038/ncomms9073
PubMed Abstract | CrossRef Full Text | Google Scholar
Gibson, E. M., Purger, D., Mount, C. W., Goldstein, A. K., Lin, G. L., Wood, L. S., et al. (2014). Neuronaalinen aktiivisuus edistää oligodendrogeneesiä ja adaptiivista myelinisaatiota nisäkkäiden aivoissa. Science 344:1252304. doi: 10.1126/science.1252304
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Li, A. M., and Grutzendler, J. (2018). Elinikäinen kortikaalinen myeliinin plastisuus ja ikään liittyvä rappeutuminen elävissä nisäkkäiden aivoissa. Nat. Neurosci. 21, 683-695. doi: 10.1038/s41593-018-0120-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Patel, K. D., Goncalves, C. M., Grutzendler, J. ja Nishiyama, A. (2014). Oligodendrosyyttien sukupolven modulointi kriittisen ajallisen ikkunan aikana NG2-solun jakautumisen jälkeen. Nat. Neurosci. 17, 1518-1527. doi: 10.1038/nn.3815
PubMed Abstract | CrossRef Full Text | Google Scholar
Horton, N. G., Wang, K., Kobat, D., Clark, C. G., Wise, F. W., Schaffer, C. B., et al. (2013). In vivo kolmen fotonin mikroskooppi subkortikaalisista rakenteista ehjissä hiiren aivoissa. Nat. Photonics 7, 205-209. doi: 10.1038/NPHOTON.2012.336
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, B., Wei, W., Wang, G., Gaertig, M. A., Feng, Y., Wang, W., et al. (2015). Mutantti huntingtin downreguloi myeliinin säätelytekijän välittämää myeliinigeenin ilmentymistä ja vaikuttaa kypsiin oligodendrosyytteihin. Neuron 85, 1212-1226. doi: 10.1016/j.neuron.2015.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Kang, S. H., Fukaya, M. ja Bergles, D. E. (2013). Oligodendrosyyttien esiasteet tasapainottavat kasvua ja itsetorjuntaa homeostaasin saavuttamiseksi aikuisten aivoissa. Nat. Neurosci. 16, 668-676. doi: 10.1038/nn.3390
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J., ja Bergles, D. E. (2018). Myeliinin uudelleenmuodostus kokemuksesta riippuvan oligodendrogeneesin kautta aikuisen somatosensorisessa aivokuoressa. Nat. Neurosci. 21, 696-706. doi: 10.1038/s41593-018-0121-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Jung, J. C., Mehta, A. D., Aksay, E., Stepnoski, R. ja Schnitzer, M. J. (2004). Nisäkkäiden aivojen in vivo -kuvantaminen käyttäen yksi- ja kaksifotonista fluoresenssimikroendoskopiaa. J. Neurophysiol. 92, 3121-3133. doi: 10.1152/jn.00234.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kang, S. H., Li, Y., Fukaya, M., Lorenzini, I., Cleveland, D. W., Ostrow, L. W., ym. et al. (2013). Harmaan aineen oligodendrosyyttien rappeutuminen ja heikentynyt uusiutuminen amyotrofisessa lateraaliskleroosissa. Nat. Neurosci. 16, 571-579. doi: 10.1038/nn.3357
PubMed Abstract | CrossRef Full Text | Google Scholar
Koudelka, S., Voas, M. G., Almeida, R. G., Baraban, M., Soetaert, J., Meyer, M. P., et al. (2016). Yksittäisillä hermosolujen alatyypeillä on monimuotoisuutta synaptisten vesikkelien vapautumisen välittämässä CNS-myelinaatiossa. Curr. Biol. 26, 1447-1455. doi: 10.1016/j.cub.2016.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Kougioumtzidou, E., Shimizu, T., Hamilton, N. B., Tohyama, K., Sprengel, R., Monyer, H., ym. et al (2017). Oligodendrosyyttien esiasteiden AMPA-reseptorien kautta tapahtuva signalointi edistää myelinisaatiota tehostamalla oligodendrosyyttien selviytymistä. eLife 6:e28080. doi: 10.7554/eLife.28080
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, J., Kim, M., Park, H., Kang, B.-M., Jo, Y., Kim, J.-H., et al. (2017). Merkinnätön nanokokoluokan optinen metrologia myelinoiduissa aksoneissa in vivo. Nat. Commun. 8:1832. doi: 10.1038/s41467-017-01979-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P., ja Webb, W. W. (2004). Syvän aivokudoksen in vivo monifotonimikroskopia. J. Neurophysiol. 91, 1908-1912. doi: 10.1152/jn.01007.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lim, H., Sharoukhov, D., Kassim, I., Zhang, Y., Salzer, J. L. ja Melendez-Vasquez, C. V. (2014). Schwannin solujen myelinisaation merkkausvapaa kuvantaminen kolmannen harmonisen sukupolven mikroskopialla. Proc. Natl. Acad. Sci. U.S.A. 111, 18025-18030. doi: 10.1073/pnas.1417820111
PubMed Abstract | Ref Full Text | Google Scholar
Locatelli, G., Theodorou, D., Kendirli, A., Jordão, M. J. C., Staszewski, O., Phulphagar, K., et al. (2018). Mononukleaariset fagosyytit määrittelevät paikallisesti ja sopeuttavat fenotyyppinsä multippeliskleroosimallissa. Nat. Neurosci. 21, 1196-1208. doi: 10.1038/s41593-018-0212-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett-Barron, M., Andalman, A. S., Allen, W. E., Vesuna, S., Kauvar, I., Burns, V. M., et al. (2017). Aivojen tilan koordinoidun moduloinnin esi-isäpiirit. Cell 171, 1411-1423. doi: 10.1016/j.cell.2017.10.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Mabbott, D. J., Noseworthy, M., Bouffet, E., Laughlin, S. ja Rockel, C. (2006). Valkoisen aineen kasvu lasten kognitiivisen kehityksen mekanismina. Neuroimage 33, 936-946. doi: 10.1016/j.neuroimage.2006.07.024
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenzie, I. A., Ohayon, D., Li, H., Paes de Faria, J., Emery, B., Tohyama, K., et al. (2014). Motoristen taitojen oppiminen edellyttää aktiivista keskusmyelinaatiota. Science 346, 318-322. doi: 10.1126/science.1254960
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitew, S., Gobius, I., Fenlon, L. R., McDougall, S. J., Hawkes, D., Xing, Y. L., et al. (2018). Neuronaalisen aktiivisuuden farmakogeneettinen stimulaatio lisää myelinisaatiota aksonispesifisellä tavalla. Nat. Commun. 9:306. doi: 10.1038/s41467-017-02719-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mount, C. W., and Monje, M. (2017). Kääritty sopeutumaan: kokemuksesta riippuvainen myelinaatio. Neuron 95, 743-756. doi: 10.1016/j.neuron.2017.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Ouzounov, D. G., Wang, T., Wang, M., Feng, D. D., Horton, N. G., Cruz-Hernández, J. C., ym. et al (2017). GCaMP6-merkittyjen neuronien aktiivisuuden in vivo-kolmifotonikuvaus syvällä ehjissä hiiren aivoissa. Nat. Methods 14, 388-390. doi: 10.1038/nmeth.4183
PubMed Abstract | CrossRef Full Text | Google Scholar
Ritchie, S. J., Bastin, M. E., Tucker-Drob, E. M., Maniega, S. M., Engelhardt, L. E., Cox, S. R., et al. (2015). Aivojen valkoisen aineen mikrorakenteen ja nestemäisen älykkyyden yhdistetyt muutokset myöhemmässä elämässä. J. Neurosci. PDGFRA/NG2-gliat tuottavat myelinoivia oligodendrosyyttejä ja piriformisia projektioneuroneja aikuisilla hiirillä. Nat. Neurosci. 11, 1392-1401. doi: 10.1038/nn.2220
PubMed Abstract | CrossRef Full Text | Google Scholar
Sampaio-Baptista, C., Khrapitchev, A. A., Foxley, S., Schlagheck, T., Scholz, J., Jbabdi, S., et al. (2013). Motoristen taitojen oppiminen aiheuttaa muutoksia valkoisen aineen mikrorakenteessa ja myelinisaatiossa. J. Neurosci. 33, 19499-19503. doi: 10.1523/jneurosci.3048-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Scantlebury, N., Cunningham, T., Dockstader, C., Laughlin, S., Gaetz, W., Rockel, C., et al. (2014). Valkoisen aineen kypsymisen ja reaktioajan väliset suhteet lapsuudessa. J. Int. Neurophsychol. Soc. 20, 99-112. doi: 10.1017/S1355617713001148
PubMed Abstract | CrossRef Full Text | Google Scholar
Schain, A. J., Hill, R. A., and Grutzendler, J. (2014). Myelinoituneiden aksonien merkkausvapaa in vivo -kuvantaminen terveydessä ja sairaudessa spektraalisella konfokaalisella heijastusmikroskopialla. Nat. Med. 20, 443-449. doi: 10.1038/nm.3495
PubMed Abstract | CrossRef Full Text | Google Scholar
Scholz, J., Klein, M. C., Behrens, T. E. J., and Johansen-berg, H. (2009). Koulutus aiheuttaa muutoksia valkoisen aineen arkkitehtuurissa. Nat. Neurosci. 12, 1370-1371. doi: 10.1038/nn.2412
PubMed Abstract | CrossRef Full Text | Google Scholar
Snaidero, N., Möbius, W., Czopka, T., Hekking, L. H. P., Mathisen, C., Verkleij, D., et al. (2014). CNS-aksonien myeliinikalvon kääriminen PI(3,4,5)P3-riippuvaisella polarisoidulla kasvulla sisäkielekkeellä. Cell 156, 277-290. doi: 10.1016/j.cell.2013.11.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Takahashi, N., Sakurai, T., Davis, K. L., and Buxbaum, J. D. (2011). Oligodendrosyyttien ja myeliinin toimintahäiriöiden yhdistäminen neuropiirin poikkeavuuksiin skitsofreniassa. Prog. Neurobiol. 93, 13-24. doi: 10.1016/j.pneurobio.2010.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tomassy, G. S., Berger, D. R., Chen, H.-H., Kasthuri, N., Hayworth, K. J., Vercelli, A. ym. et al. (2014). Erilaiset myeliinin jakautumisen profiilit pyramidineuronien yksittäisten aksonien varrella neocortexissa. Science 344, 319-324. doi: 10.1126/science.1249766
PubMed Abstract | CrossRef Full Text | Google Scholar
Tripathi, R. B., Jackiewicz, M., Mckenzie, I. A., Kougioumtzidou, E., Grist, M., ja Richardson, W. D. (2017). Myelinoivien oligodendrosyyttien huomattava vakaus hiirillä. Cell Rep. 21, 316-323. doi: 10.1016/j.celrep.2017.09.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Viganò, F., Möbius, W., Götz, M., and Dimou, L. (2013). Siirto paljastaa alueellisia eroja oligodendrosyyttien erilaistumisessa aikuisten aivoissa. Nat. Neurosci. 16, 1370-1372. doi: 10.1038/nn.3503
PubMed Abstract | CrossRef Full Text | Google Scholar
Watkins, T. A., Emery, B., Mulinyawe, S. ja Barres, B. A. (2008). Gammasekretaasin ja astrosyyttien säätelemät erilliset myelinisaatiovaiheet nopeasti myelinisoituvassa CNS-kokkiviljelyjärjestelmässä. Neuron 60, 555-569. doi: 10.1016/j.neuron.2008.09.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Waxman, S. G. (1980). Johtumisnopeuden määräävät tekijät myelinoituneissa hermosäikeissä. Muscle Nerve 3, 141-150. doi: 10.1002/mus.880030207
PubMed Abstract | CrossRef Full Text | Google Scholar
Xiao, L., Ohayon, D., Mckenzie, I. A., Sinclair-Wilson, A., A., Wright, J. L., Fudge, A. D., ym. et al. (2016). Uusien oligodendrosyyttien nopeaa tuotantoa tarvitaan motoristen taitojen oppimisen varhaisimmissa vaiheissa. Nat. Neurosci. 19, 1210-1217. doi: 10.1038/nn.4351
PubMed Abstract | CrossRef Full Text | Google Scholar
Yeung, M. S. Y., Zdunek, S., Bergmann, O., Bernard, S., Salehpour, M., Alkass, K., et al. (2014). Oligodendrosyyttien synnyn ja myelinisaation dynamiikka ihmisen aivoissa. Cell 159, 766-774. doi: 10.1016/j.cell.2014.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Young, K. M., Psachoulia, K., Tripathi, R. B., Dunn, S.-J., Cossell, L., Attwell, D., et al. (2013). Oligodendrosyyttien dynamiikka terveessä aikuisen keskushermostossa: todisteita myeliinin uudelleenmuotoilusta. Neuron 77, 873-885. doi: 10.1016/j.neuron.2013.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, H. (2018). Mesoskaalan konnektomiikka. Curr. Opin. Neurobiol. 50, 154-162. doi: 10.1016/j.conb.2018.03.003
PubMed Abstract | CrossRef Full Text | Google Scholar