Aspartate Aminotransferaseby Luke Spooner
Sisältö
- 1 Toiminta
- 2 Rakenne
- 3 Toiminta
- 4 Kliiniset sovellukset
- 5 Aspartaattiaminotransferaasin 3D-rakenteet
Toiminta
Aspartaattiaminotransferaasi (AAT), tunnetaan myös nimillä glutamaattiaspartaattitransaminaasi, glutamaattioksaloetikkatransaminaasi, prefenaattiaminotransferaasi ja transaminaasi A on entsyymi, joka kuuluu I-luokan pyridoksaalifosfaatti-riippuvaisten aminotransferaasien perheeseen . Sitä koodaa geeni GOT1. Se on 413 aminohapon pituinen homodimeeri, jolla on kriittinen tehtävä aminohappo- ja hiilihydraattiaineenvaihdunnassa, ureogeneesissä ja pelkistävien ekvivalenttien siirrossa mitokondrioihin ja kloroplastiin. Prokaryoottisoluissa sitä esiintyy yksinomaan sytosolissa, mutta eukaryoottisoluissa on sytosoli-, mitokondrio- ja kloroplasti-isoentsyymejä. Bifunktionaalista aspartaattiaminotransferaasia (BAAT) tarvitaan prefanaatin transaminaatioon arogenaatiksi.
Ihmiskehossa sitä tuotetaan aivoissa, luurankolihaksissa, maksassa, haimassa, punasoluissa ja munuaisissa . Laaja valikoima kudoksia, joissa sitä valmistetaan, erottaa sen samankaltaisesta entsyymistä alaniinitransaminaasi (ALT), jota esiintyy pääasiassa maksassa. AAT:n määrää elimistössä voidaan käyttää kudostautien tai -vaurioiden merkkiaineena. Samoin AAT- ja ALT-tasoja voidaan verrata sen määrittämiseksi, onko kudosvaurio ensisijaisesti maksassa.
Rakenne
, joka sisältää (alfaheliksiä, beetasäikeitä , silmukoita , käänteitä). Aspartaattiaminotransferaasin epäsymmetrinen yksikkö, jossa on korostettu pieni ja suuri domeeni ja PLP-kofaktori (1b4x). Kumpikin alayksikkö sisältää vastaavan aktiivisen alueen. Alayksiköt liittyvät toisiinsa kahdessa kohdassa: niiden suurten domeenien välillä sekä N-terminaalisten jäännösten ja toisen alayksikön suuren domeenin välillä. Tämä AST:n rakenne vaihtelee hyvin vähän eri organismeissa E. colista ihmisiin. Myös aktiivisen alueen rakenne on hyvin konservoitunut, ja sen sekvenssihomologia on 25 prosenttia.
Homodimeerin kukin alayksikkö jakautuu edelleen pieneen ja suureen domeeniin. Se koostuu aminohapoista N-terminaalista Pro 48 -jäämään ja Met 326:sta C-terminaaliin. Loput aminohapot muodostavat , ja niitä yhdistää pitkä α-kierre, joka koostuu 32 aminohaposta.
Suuri domeeni on paikka, jossa AAT:n aktiivinen keskus sijaitsee, ja tätä varten ytimessä on monia α/β-supersekundaarirakenteita. Tämä eroaa pienen alayksikön ytimestä, joka muodostuu kahdesta α-heliksistä ja kahdesta β-säikeestä. Monisoluisissa organismeissa on 325. jäännöksen kohdalla mutka, joka toimii pienen domeenin saranana, mikä mahdollistaa konformaatiomuutokset, jotka tapahtuvat inhibiittorien sitoutuessa entsyymiin.
Kuten edellä todettiin, AST:n aktiivinen keskus sijaitsee alayksikön suurella domeenilla. Aktiivisen alueen sisällä on aminojäännös Lys 258, joka tunnetaan myös nimellä sisäinen aldimiini, joka sitoutuu kofaktorin Pyridoxal 5′-fosfaatin () kanssa muodostaen niin sanotun Schiffin emäksen. Kun aminohapposubstraattia lisätään, PLP:n ja aminohapon välille muodostuu uusi Schiiff-emäs.
Tehtävä
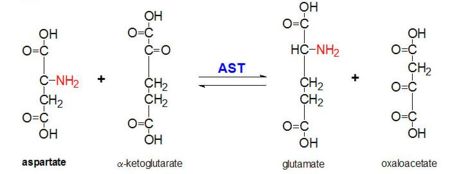
Kuvio 2. Piiffioksidi: Aspartaattiaminotransferaasin katalysoima L-aspartaatin ja α-ketoglutaraatin transaminaatioreaktio
AAT katalysoi L-aspartaatista peräisin olevan α-aminoryhmän reversiibeliä transaminaatiota α-ketoglutaraattiin muodostaen oksaloasetaattia ja glutamaattia. Tämä reaktiivisuus on vähäisempää E.colissa kuin korkeammissa eukaryooteissa, ja sillä on laajempi substraattispesifisyys. Reaktio tapahtuu kuitenkin samalla tavalla. Kun aminohapposubstraatti lisätään, sen ja PLP-kofaktorin välille muodostuu uusi Schiffin emäs. Tämä saa aikaan sen, että aminohappo menettää vedyn ja muodostaa kvinoidivälituotteen, ja reprotanaatio tapahtuu, jolloin syntyy ketimiini. Seuraavaksi rakenne hydrolysoituu muodostaen α-ketohapon ja pyridoksamiinifosfaatin. 2-metyyliaspartaatti toimii AAT:n estäjänä, kun se muodostaa Schiif-emäksen PLP-kofaktorin kanssa aspartaatin sijasta. Tämä johtaa siihen, että prosessi pysähtyy alfaproteiinin eliminaatiota edeltävään vaiheeseen.
Tämä reaktio on välttämätön elimistön homeostaasin ylläpitämiseksi. Neljä erilaista molekyyliä, jotka voivat muodostua tämän transanimaation tuloksena (oksaloasetaatti, α-ketoglutaraatti, aspartaatti, L-glutamaatti), ovat kriittisiä useiden aineenvaihduntaprosessien kannalta. Oksaloasetaatilla ja α-ketoglutaraatilla on kriittinen rooli Krebsin syklissä, aspartaatin eri muodot ovat tärkeitä molekyylejä ureakierrossa ja osallistuvat glukoneogeneesiin, ja glutamaatti on tärkeä molekyyli muistiin liittyvissä aineenvaihdunnallisissa reiteissä.
Kliiniset sovellukset
AAT:n pitoisuudet elimistössä osoittavat kudosvaurioita ja -sairauksia. Normaalisti AAT:ta esiintyy veressä minimaalisia määriä, mutta kun edellä mainitut elimet vaurioituvat, AAT:ta vapautuu vereen. Vapautuva määrä on verrannollinen vaurion tasoon. AAT-tasojen on osoitettu nousevan huomattavasti 6 tunnin kuluessa kudoksen alkuvaiheen vaurioitumisesta, ja ne voivat pysyä koholla jopa 4 päivän ajan. Kun AAT-tasoja verrataan muiden entsyymien tasoihin, lääkärit voivat käyttää niitä määrittämään, missä kohtaa kehoa vaurio on tapahtunut. Vertailu ALT:hen on osoittautunut erityisen hyödylliseksi maksavaurioiden, kuten kirroosin ja hepatiitin, tunnistamisessa. Normaalitilanteessa AAT-tasot ovat miehillä 6-34 IU/L ja naisilla 8-40 IU/L.
Aspartaattiaminotransferaasin 3D-rakenteet
Aspartaattiaminotransferaasin 3D-rakenteet