Kemiallisten reaktioiden kuvaaminen
Tässä luvussa tutustumme joihinkin reaktioihin, joiden keskeisiin vaiheisiin liittyy yksittäisten elektronien siirtyminen. Muistatte ehkä jo luvusta 6.1A, että yksittäisen elektronin liikettä kuvataan yhden elektronin ”kalakoukun” nuolella (vastakohtana tutuille kahden elektronin liikettä kuvaaville kahden elektronin nuolille, joita olemme käyttäneet koko kirjan ajan kahden elektronin liikkeen kuvaamiseen).

Yksielektronimekanismeihin liittyy vapaiden radikaalilajien, erittäin epävakaiden välituotteiden, jotka sisältävät parittoman elektronin, muodostuminen ja sitä seuraava reaktio. Opimme tässä luvussa, miten vapaita radikaaleja muodostuu usein homolyyttisessä pilkkoutumisessa, tapahtumassa, jossa kaksi elektronia liikkuvat rikkoutuvassa kovalenttisessa sidoksessa vastakkaisiin suuntiin.

(Sitä vastoin olennaisesti kaikissa tähän mennessä tutkimissamme reaktioissa on kyse sidoksen rikkoutumistapahtumista, joissa kumpikin elektroni liikkuu samansuuntaisesti: tätä kutsutaan heterolyyttiseksi pilkkoutumiseksi).
Olemme myös oppineet, että monet yhden elektronin mekanismit toteutuvat radikaalien ketjureaktiona, jossa yksi radikaali saa aikaan toisen radikaalin muodostumisen, joka puolestaan saa aikaan kolmannen radikaalin muodostumisen ja niin edelleen.
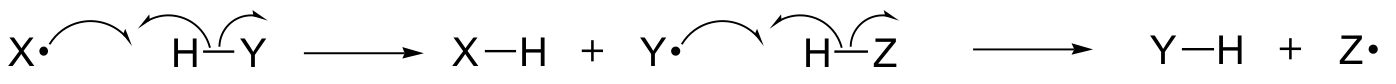
Vapaiden radikaalilajien suuri reaktiivisuus ja niiden kyky käynnistää ketjureaktioita on usein hyödyllistä – opimme tässä luvussa radikaalipolymerisaatioreaktioista, joiden avulla muodostuu käyttökelpoisia materiaaleja, kuten pleksilasi- ja polypropeenikangasta. Opimme myös radikaalireaktioista, jotka ovat haitallisia, kuten freonin aiheuttamasta ilmakehän otsonin hajoamisesta ja vapaiden radikaalien elimistömme lipideille ja DNA:lle aiheuttamista hapettumisvaurioista. Lopuksi näemme, miten jotkin entsyymit käyttävät sidottuja metalleja katalysoidakseen korkeita e
Hiiliradikaalien geometria ja suhteellinen stabiilisuus
Orgaanisina kemisteinä olemme erityisen kiinnostuneita radikaalien välituotteista, joissa parittamaton elektroni sijaitsee hiiliatomilla. Kokeelliset todisteet osoittavat, että hiiliradikaalin kolmella sidoksella on trigonaalinen tasogeometria, ja siksi hiilen katsotaan olevan sp2-hybridisoitunut, jolloin parittamaton elektroni sijaitsee kohtisuorassa, hybridisoitumattomassa 2pzorbitaalissa. Vastakohtana tälle kuvalle ovat karbokationin ja karbanionin välituotteet, jotka molemmat ovat myös trigonaalisen planaarisia, mutta joiden 2pz-orbitaaleissa on vastaavasti nolla tai kaksi elektronia.

Hiilariradikaalien stabiilisuuden suuntaus on samansuuntainen kuin karbokationien (luku 8.4B): esimerkiksi tertiääriset radikaalit ovat stabiilimpia kuin sekundääriset radikaalit, ja niiden jälkeen tulevat primaari- ja metyyliradikaalit. Tämän pitäisi olla intuitiivisesti ymmärrettävää, koska radikaaleja, kuten karbokationeja, voidaan pitää elektronipuutteisina, ja näin ollen läheisten alkyyliryhmien elektronia luovuttavat vaikutukset stabiloivat niitä. Bentsyyli- ja allyyliradikaalit ovat vakaampia kuin alkyyliradikaalit resonanssivaikutusten vuoksi – parittamaton elektroni voi delokalisoitua konjugoitujen piisidosten järjestelmään. Esimerkiksi allyyliradikaalia voidaan kuvata kolmen rinnakkaisen 2pz-orbitaalin järjestelmänä, jossa on kolme elektronia jaettuna.
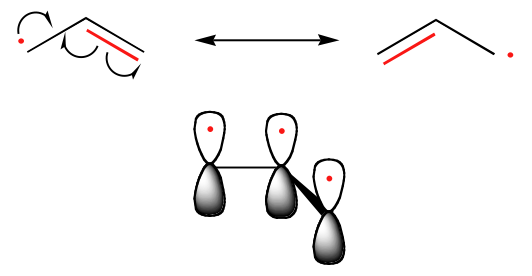
Trendit radikaalien stabiilisuudessa
Allyyli & Bentsyyli > 3o > 2o > 1o > Metyyli

Tässä molekyylissä jo ennestään laajaa resonanssistabilointia tehostaa entisestään klooriatomien kyky suojata radikaalikeskusta ulkoisilta reagensseilta. Radikaali on tavallaan suojaavan ”häkin” sisällä.
Organic Chemistry With a Biological Emphasis Tim Soderberg (Minnesotan yliopisto, Morris)
-
Prof. Steven Farmer (Sonoma State University)
- Layne A. Morsch (Illinoisin yliopisto Springfield)