Předchozí část ukazuje, jak mohou různé prvky existovat buď samostatně, nebo se spojovat s jinými prvky a vytvářet sloučeniny. Tato část navazuje na tyto myšlenky a podrobněji se zabývá chemickými reakcemi. Ukazuje také, jak lze chemickou zkratku rozšířit na popis chemických reakcí.
Nejprve se zamyslete nad některými z dříve popsaných molekul: voda, metan, oxid uhličitý a amoniak.
Otázka 26
Jaké jsou vzorce každé z těchto čtyř molekul?
Odpověď
Jedná se o vzorce H2O, CH4, CO2 a NH3.
Ačkoli si nemusíte pamatovat chemické vzorce sloučenin představených v tomto kurzu, bude pro vás pravděpodobně užitečné zapamatovat si několik vzorců, například vzorce čtyř výše uvedených molekul a vzorce molekul vodíku (H2), dusíku (N2) a kyslíku (O2). To vám pomůže při čtení a psaní těchto chemických vzorců, aniž byste se museli neustále vracet k předchozím částem.
Nyní se budete zabývat reakcemi zahrnujícími prvky vodík, uhlík a kyslík a sloučeniny metan, voda a oxid uhličitý.
Vodík při zapálení reaguje s kyslíkem (je poměrně výbušný) za vzniku vody. Chceme-li takovou reakci zapsat ve formě chemické rovnice, uvedeme vlevo látky, které reakci podléhají, a vpravo látky, které při reakci vznikají. Reaktanty vlevo jsou spojeny s produkty vpravo šipkou.
Rovnici lze zapsat jako slovní rovnici „z vodíku a kyslíku vzniká voda“ nebo ji lze s použitím malé chemické zkratky zapsat takto:

kde šipka znamená „přechází do“.
Nyní zkus použít chemickou zkratku k zápisu rovnice. Dosazením symbolů do slovní rovnice dostaneme:

Rovnice ukazuje, že reaktanty vlevo od šipky se přeměňují na produkt vpravo. V této rovnici je však něco špatně. Co je špatně, zjistíte, když se podíváte na obrázek 21, kde jsou reaktanty a produkty znázorněny jako diagram.
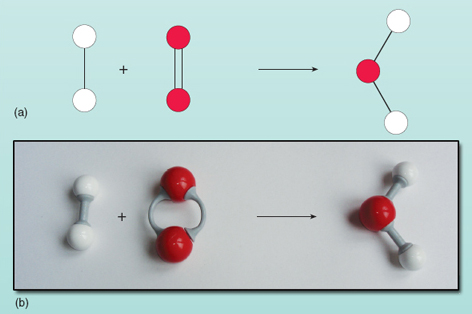
Počítáním počtu atomů na každé straně rovnice zjistíme, že na levé straně jsou dva atomy kyslíku ve srovnání s jedním na pravé straně. Počet atomů kyslíku na obou stranách rovnice musí být stejný – během reakce se nemohou zázračně objevovat a mizet. Složení molekuly vody na pravé straně rovnice není možné změnit, protože molekula vody existuje jako skupina dvou atomů vodíku a jednoho atomu kyslíku, které jsou spolu vázány. Každá molekula kyslíku dodává dva atomy kyslíku, takže vždy vytvoří dvě molekuly vody za předpokladu, že existují dvě molekuly vodíku (každá je jednotkou dvou atomů), které s ní mohou reagovat. K vytvoření dvou molekul vody jsou tedy zapotřebí dvě molekuly vodíku a jedna molekula kyslíku. Reakce je přesně vyjádřena takto:

Na obou stranách rovnice je nyní stejný počet atomů každého typu: chemická rovnice je vyvážená, takže nyní můžeme šipku nahradit znaménkem rovnosti.
Závěrečný úklid, abychom se vyhnuli opakování molekul vodíku na levé straně rovnice a molekul vody na pravé straně, spočívá v jejich znázornění pomocí 2H2 místo H2 + H2. Vyvážená chemická rovnice tedy vypadá takto:

To je schematicky znázorněno na obrázku 22.

Chemické rovnice velmi stručně ukazují nejen to, které atomy a molekuly spolu reagují za vzniku produktů, ale také kolik jednotlivých druhů atomů a molekul se na reakci podílí. Je důležité si uvědomit, že číslo před molekulou znamená počet této konkrétní molekuly. Například 3H2O znamená tři molekuly vody, což dává celkem šest atomů vodíku a tři atomy kyslíku.
Chemické rovnice musí být vyvážené; počet atomů každého druhu prvku na obou stranách rovnice musí být stejný.
Ty nyní víš, jak „číst“ nebo interpretovat chemickou rovnici – a jak představuje chemický proces. Chemici jsou však také velmi zběhlí v psaní chemických rovnic jako formy zkratky pro popis různých chemických procesů nebo reakcí. Psaní chemických rovnic je jako psaní v jakémkoli cizím jazyce – vyžaduje praxi, abyste se v něm zdokonalili. Všichni začínající vědci však musí někde začít a následující část vám ukáže, jak na to pomocí velmi známé chemické reakce. Pokud si chcete ověřit, zda tuto část potřebujete nastudovat, zkuste nejprve otázku 20.
.