Tato struktura vzniká, když se dva (nebo více, např. ψ-smyčka) segmenty polypeptidového řetězce navzájem překrývají a tvoří mezi sebou řadu vodíkových vazeb. K tomu může dojít v paralelním uspořádání:

nebo v antiparalelním uspořádání:
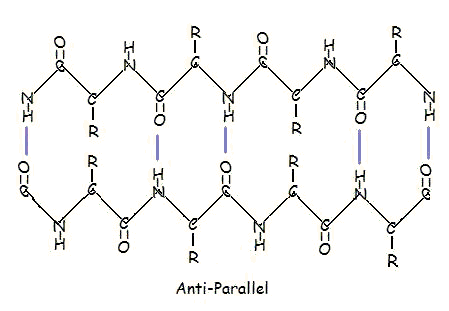
Paralelní a antiparalelní uspořádání je přímým důsledkem směrovosti polypeptidového řetězce. Při antiparalelním uspořádání je C-konec jednoho segmentu na stejné straně jako N-konec druhého segmentu. Při paralelním uspořádání jsou C-konec a N-konec obou segmentů na stejné straně. K „záhybu“ dochází kvůli střídání rovin peptidových vazeb mezi aminokyselinami; zarovnané aminoskupiny a karbonylové skupiny každého protilehlého segmentu střídají svou orientaci od orientace směrem k sobě až po opačné směry.
Rovnoběžné uspořádání je méně stabilní, protože geometrie jednotlivých molekul aminokyselin nutí vodíkové vazby vznikat pod úhlem, čímž jsou delší, a tudíž slabší. Naopak v antiparalelním uspořádání jsou vodíkové vazby uspořádány přímo proti sobě, což vytváří silnější a stabilnější vazby.
Obvykle se antiparalelní beta-pleated sheet vytvoří, když polypeptidový řetězec prudce změní směr. K tomu může dojít v přítomnosti dvou po sobě jdoucích prolinových zbytků, které vytvoří v polypeptidovém řetězci úhlové zalomení a ohnou ho zpět na sebe. U vzdálených segmentů polypeptidového řetězce to není nutné, aby se vytvořily beta-skládané listy, ale u proximálních segmentů je to jednoznačný požadavek. Pro krátké vzdálenosti jsou dva segmenty beta-pleated listu odděleny 4+2n aminokyselinovými zbytky, přičemž minimální počet zbytků je 4.
.