Všeobecné vlastnosti solí
Některé charakteristické vlastnosti solí jsou:
- Teplota tání a varu:
- Rozpustnost ve vodě: Soli jsou většinou pevné látky, které při vysokých teplotách tají i vřou: Soli jsou obecně rozpustné ve vodě. Například chlorid sodný, síran draselný, dusičnan hlinitý, uhličitan amonný atd. jsou rozpustné soli, zatímco chlorid stříbrný, chlorid olovnatý, uhličitan měďnatý atd. jsou ve vodě nerozpustné.
- Krystalizační voda: Obecně se soli vyskytují jako krystaly s přítomnými molekulami vody. Tato voda se nazývá krystalizační voda a takové soli se nazývají hydratované soli.
Například krystal síranu měďnatého má na každou molekulu síranu měďnatého pět molekul vody. To se zapisuje jako CuSO4.5H2O. Tato krystalizační voda dává krystalu jeho tvar. Některým krystalům také dodává barvu. Při zahřívání hydratované soli ztrácejí svou krystalizační vodu, v důsledku čehož krystaly ztrácejí svůj tvar a barvu a mění se na práškovitou látku.
Hydratované soli, které ztratily svou krystalizační vodu, se nazývají bezvodé soli.
Při zahřívání hydratovaný síran měďnatý odevzdává molekuly vody za vzniku bílého práškovitého bezvodého síranu měďnatého. Po přidání vody se tato látka může opět přeměnit na hydratovaný roztok síranu měďnatého.
Lidé se také ptají
- Klasifikace solí
- Použití různých solí v každodenním životě
- Příprava solí
- Popište přípravu rozpustných a nerozpustných solí
- Kvalitativně. Analýza solí
- Působení tepla na soli
- Zkouška kationtů a aniontů ve vodných roztocích
- Sestavení iontových rovnic metodou spojité variace
- Co je stechiometrie a proč se používá v chemii?
Všeobecné vlastnosti solí :
1. Reakce s kyselinou : Při reakci soli s kyselinou vzniká další sůl a kyselina. Například při zahřívání chloridu sodného s kyselinou sírovou vzniká hydrogensíran sodný (při nízké teplotě) a následně síran sodný (při vysoké teplotě) a uvolňuje se plynný chlorovodík
2. Reakce se zásadou : Sůl reaguje se zásadou za vzniku jiné soli a zásady.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH
3. Reakce s kovem : Někdy může roztok soli reagovat s kovem. Například při ponoření železného hřebíku do vodného roztoku síranu měďnatého se na povrchu hřebíku usazuje měď a vzniklý síran železnatý zůstává v roztoku.
CuSO4 + Fe → FeSO4 + Cu
Tato reakce ukazuje, že železo je reaktivnější než měď.
Tak může reaktivnější kov vytěsnit méně reaktivní kov z roztoku své soli.
4. Chování solí vůči vodě :
Při rozpuštění soli ve vodě může být roztok neutrální, kyselý nebo zásaditý. To závisí na povaze použité soli.
(i) Normální sůl získaná ze silné kyseliny a silné zásady dává neutrální roztok. Například vodné roztoky NaCl a K2SO4 jsou podle lakmusu neutrální.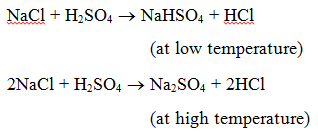
(ii) Normální sůl odvozená ze slabé kyseliny a silné zásady dává zásaditý roztok. Například vodné roztoky uhličitanu sodného (Na2CO3) i octanu sodného (CH3COONa) jsou zásadité.
Na2CO3 + 2H2O → 2NaOH + CO2 + H2O
CH3COONa + H2O → CH3COOH + NaOH
(iii) Sůl odvozená ze silné kyseliny a slabé zásady dává kyselý roztok. Například chlorid hlinitý (AlCl3) i chlorid amonný (NH4Cl) vytvářejí kyselé vodné roztoky.
AlCl3 + 3H2O → Al(OH)3 + 3HCl
NH4Cl + H2O → NH4OH + HCl
(iv) Roztoky kyselých solí jsou kyselé až lakmusové, tj. tyto roztoky zbarvují modrý lakmusový papírek do červena. Například roztok hydrogensíranu sodného (NaHSO4) zbarví lakmusový papírek modře červeně.
Roztok hydrogenuhličitanu sodného (NaHCO3) je však mírně zásaditý
.