Přemýšleli jste někdy o tom, proč svítící tyčinky (viz obr. 1) po ohnutí svítí? Nebo proč ty plastové hvězdičky svítí i v noci po zhasnutí světel? Možná jste to neudělali. Ať už jste si však tyto otázky kladli, nebo ne, následující text vám snad poskytne odpovědi a vysvětlení jevů, jako jsou svítící náramky, svítící medúzy, černé světlo a mnoho dalších.

Obrázek 1: Svítící náramky. Svítící tyčinky.
Luminiscence
Všeobecně se záře, která se vyskytuje u všech výše uvedených jevů, nazývá luminiscence. Luminiscence je energie uvolňovaná látkou ve formě světla . Lze rozlišit několik typů luminiscence:
- Jedním z příkladů je chemiluminiscence. Při některých chemických reakcích se energie uvolňuje ve formě světla. K tomu dochází po ohnutí svítící tyčinky. Je také důvodem svícení živočichů, jako jsou medúzy nebo některé mikroorganismy. V tomto případě se nazývá bioluminiscence .
- Dalším druhem je triboluminiscence. Tu lze pozorovat při otevření samolepicí obálky v úplné tmě nebo při rozvinutí lepicí pásky v tmavé místnosti. Přitom je do systému vložena mechanická energie, která slouží jako aktivátor záře .
- Pravděpodobně nejznámějším druhem luminiscence je fotoluminiscence. Zde je energie dodávána elektromagnetickým zářením, například prostřednictvím slunečního světla nebo ultrafialové lampy, jako v některých diskotékách. To způsobuje jevy, jako je trvalá záře plastových hvězd nebo extrémní jas bílého oblečení pod černým světlem. Lze rozlišovat fluorescenci a fosforescenci, které budou vysvětleny níže .
Co je to elektronicky excitovaný stav?
Všeobecně jsou všechny druhy luminiscence založeny na tzv. fotofyzikálních procesech. Obvykle se samotné molekuly popisují jako fluoreskující. To je případ fluorescenčních barviv, jako je fluorescein nebo kurkumin . Pro vysvětlení fotofyzikálních procesů je však třeba podívat se blíže na ještě menší úroveň, než je ta molekulární.
Atomy různých prvků mají různý počet elektronů rozložených do několika slupek a orbitalů. Elektrony jsou typem elementárních částic. Elektronické přechody jsou zodpovědné za luminiscenci . Když systém absorbuje energii, elektrony jsou excitovány a jsou vyzdviženy do vyššího energetického stavu. Před excitací, v základním stavu, se některé elektrony nacházejí v takzvaném HOMO (Highest Occupied Molecular Orbital). Po dosažení excitovaného stavu se nacházejí v LUMO (Lowest Unoccupied Molecular Orbital) (viz obr. 2). Jak to přesně funguje, si vysvětlíme na konkrétním příkladu fotoluminiscence.

Obrázek 2. Elektronická excitace.
Různé energetické stavy atomu nebo molekuly se nazývají „energetické hladiny“. V závislosti na molekule a atomu mohou elektrony zaujímat pouze diskrétní energetické hladiny, protože energie je kvantovaná, což znamená, že energii lze absorbovat a emitovat pouze v určitém množství . Rozdíl mezi dvěma hladinami lze vypočítat pomocí rovnice 1 (kde E2 je vyšší energetická hladina a E1 nižší).
(1) ΔE = E2-E1
Fotony, částice, z nichž se skládá elektromagnetické záření nebo světlo, musí mít určitou hodnotu energie, aby mohly excitovat elektrony. Energii fotonu lze vypočítat pomocí rovnice 2, kde h je Planckova konstanta a ν je frekvence světla.
(2) Ephoton = hν
Potřebná excitační energie pro elektrony se rovná rozdílu mezi energetickými hladinami. Pouze světlo s určitou energií a podle toho s určitou frekvencí a vlnovou délkou je schopno excitovat elektrony . Vyrovnáním rovnic 1 a 2 a pomocí rovnice 3 (kde c znamená rychlost světla) lze vypočítat potřebnou frekvenci a vlnovou délku (viz rovnice 4) . V mnoha případech se k excitaci používá UV záření.
(3) λ = c/ν
(4) ΔE = efoton ⇔ E2 – E1 = hν
ν = (E2 – E1)/h
λ = hc/(E2 – E1)
Deaktivace elektronicky excitovaných stavů
Takové elektronicky excitované stavy jsou nestabilní. Elektrony klesají zpět do svých základních stavů. Současně se opět uvolňuje excitační energie. Rozlišují se zářivé a nezářivé procesy rozpadu. Většinou se jedná o nezářivý rozpad, například prostřednictvím vibrační relaxace, zhášení okolními molekulami nebo vnitřní přeměny (IC) . Tyto procesy budou podrobně vysvětleny později.
Někdy může nastat zářivý rozpad ve formě fluorescence a fosforescence. Energie je emitována jako elektromagnetické záření nebo fotony. Vyzářené světlo má delší vlnovou délku a nižší energii než absorbované světlo, protože část energie již byla uvolněna v procesu nezářivého rozpadu . To je důvod, proč lze emise ve viditelném spektru dosáhnout excitací neviditelným UV zářením. Tento posun směrem k delší vlnové délce se nazývá Stokesův posun .
Srovnání: Fluorescence vs. fosforescence
Fluorescence i fosforescence jsou spontánní emise elektromagnetického záření. Rozdíl spočívá v tom, že záře fluorescence ustane ihned po vypnutí zdroje excitačního záření, zatímco u fosforescence se může objevit dozáření s trváním zlomků sekundy až hodin .
Pro porovnání fotofyzikálních procesů, které stojí za oběma jevy, jsou užitečná některá fakta o elektronech: Elektrony jsou částice, které mají tzv. spin a spinové kvantové číslo. To může nabývat dvou různých hodnot, a to buď +1/2, nebo -1/2 . Toto číslo je vlastnost, kterou si vlastně neumíme představit ani snadno popsat. Často se přirovnává k točícímu se vršku, který se otáčí buď ve směru, nebo proti směru hodinových ručiček. Tento popis však není ani matematicky, ani fyzikálně zcela správný. Dva elektrony v jednom orbitalu atomu mají antiparalelní spin, který je zaznamenán jako (↓) .
Fluorescence
V Jablonského diagramu pro fluorescenci (viz obr. 3) je singletový spinový stav S0 základním stavem elektronů a S1 a S2 jsou singletové excitované stavy (tyto stavy jsou v tomto textu použity pouze jako příklad a nemusí nutně platit pro určité atomy, molekuly atd.) V rámci těchto stavů existuje několik energetických hladin. Čím vyšší je hladina, tím větší energii má elektron, který se v ní nachází. V případě singletových stavů mají elektrony antiparalelní spiny.

Obrázek 3. V případě singletových stavů mají elektrony antiparalelní spiny. Jablonského diagram pro fluorescenci.
Elektrony jsou například při excitaci elektromagnetickým zářením vyzdviženy ze základního stavu S0 na energetickou hladinu druhého excitovaného stavu S2. Po ukončení excitace zůstávají elektrony v tomto excitovaném stavu pouze krátkou dobu (cca 10-15 s) a poté začnou okamžitě klesat zpět do základního stavu . Přitom se energie může zpočátku uvolňovat do okolí vibrační relaxací. To znamená, že tepelná energie se uvolňuje pohybem atomu nebo molekuly, dokud není dosaženo nejnižší hladiny druhého excitovaného stavu.
Větší mezera mezi druhým a prvním excitovaným stavem je překonána vnitřní přeměnou. Ta popisuje elektronický přechod mezi dvěma stavy při zachování spinu elektronů. Nyní mohou elektrony dále relaxovat díky větší vibrační relaxaci, dokud nedosáhnou nejnižší energetické hladiny stavu S1.
Teoreticky by elektrony mohly relaxovat ještě dále nezářivým způsobem, až by nakonec opět dosáhly základního stavu. Může se však stát, že poslední množství energie je příliš velké na to, aby se uvolnilo do okolí, protože okolní molekuly nemohou takové množství energie absorbovat. Pak dochází k fluorescenci, která vede k emisi fotonů o určité vlnové délce. Emise trvá pouze do doby, než se elektrony vrátí do základního stavu. Protože během všech těchto přechodů zůstává spin elektronů stejný, popisují se jako spinově povolené .
Fosforescence
U fosforescence je situace trochu jiná (viz obr. 4). Opět existuje základní stav S0 a dva excitované stavy, S1 a S2. Navíc existuje excitovaný tripletový stav T1, který leží energeticky mezi stavy S0 a S1. V základním stavu mají elektrony opět antiparalelní spiny.
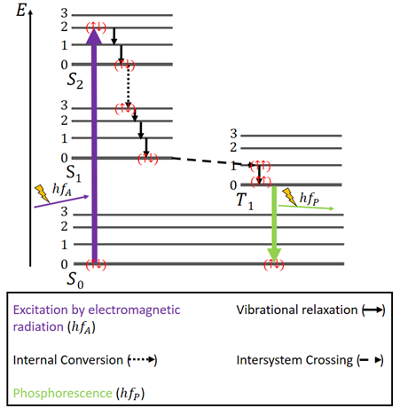
Obrázek 4. Jablonského diagram pro fosforescenci.
Excitace probíhá stejným způsobem jako u fluorescence, a to prostřednictvím elektromagnetického záření. Uvolňování energie prostřednictvím vibrační relaxace a vnitřní přeměny při zachování stejného spinu je i zde stejné, ale pouze do dosažení stavu S1.
Souběžně se singletovými stavy existuje tripletový stav a může docházet k tzv. mezisystémovému křížení (ISC), protože stav T1 je energeticky výhodnější než stav S1. Tento přechod, stejně jako vnitřní konverze, je elektronickým přechodem mezi dvěma excitovanými stavy. Na rozdíl od vnitřní konverze je však ISC spojen s obrácením spinu ze singletu na triplet. Elektrony v tripletovém stavu mají paralelní spiny, což je zaznamenáno jako () . Tento proces ISC je popisován jako „spinově zakázaný“. Není zcela nemožný – díky jevu zvanému „spin-orbitální vazba“ – je však spíše nepravděpodobný .
Ve stavu T1 je možný i nezářivý rozpad. Přechod mezi nejnižší energetickou hladinou tripletového stavu a stavem S0 však není snadno možný, protože i tento přechod je spinově zakázaný. Přesto k němu může s malou pravděpodobností dojít i tak. Způsobí poměrně slabou emisi fotonů, protože spin elektronu se musí opět obrátit. Energie je v tomto stavu na chvíli uvězněna a může se uvolňovat jen pomalu . Po uvolnění veškeré energie jsou elektrony opět v základním stavu .
Závěr
Povolené a zakázané spinové procesy slouží jako vysvětlení pro okamžitě ustávající svícení fluorescence a pro doznívání fosforescence. Fosforescence se obvykle vyskytuje pouze u „těžších“ molekul, protože spin musí být obrácen pomocí spin-orbitální vazby. Zda vůbec dojde k emisi elektromagnetického záření a s jakou vlnovou délkou, závisí na tom, kolik energie může být předem uvolněno nezářivým rozpadem . Závisí to také na vlastnostech tzv. zhášečů, které obklopují molekuly a jsou schopny pohltit větší množství energie.
Všechny procesy, které mohou vést k inhibici zářivých rozpadů, mohou způsobit zhášení fluorescence. Příkladem jsou procesy nezářivého rozpadu, ale také destrukce fluorescenční molekuly . Kvantová účinnost popisuje účinnost procesu a je definována jako poměr absorbovaných a emitovaných fotonů . Tato vlastnost je pro každou látku jiná.
Přestože se tento text zaměřuje na fotoluminiscenci, fotofyzikální procesy jsou stejné pro všechny typy luminiscence .
Použití
Kromě výrobků, jako jsou svítící tyčinky, se fluorescence a fosforescence používají mnoha dalšími způsoby. Dalšími příklady jsou vodicí sloupky vedoucí k nouzovému východu, které nepotřebují elektrické napájení, ale v noci svítí díky fosforescenci. Dokonce i rostliny mohou být fluoreskující: Špenát lze pomocí nanotechnologie upravit tak, aby dokázal detekovat stopy výbušných látek v podzemní vodě. Listy obsahují uhlíkové nanotrubičky, na které se mohou vázat nitroaromáty. Pokud se tak stane, uvolní rostlina fluorescenční signál, který lze detekovat infračervenými kamerami .
Video demonstruje různé typy luminiscence. Na levé straně ukazuje fluorescenci barviva kurkuminu, které je obsaženo v koření kurkuma, pod UV světlem . Kurkumin je rozpuštěn v alkoholu, aby byla fluorescence viditelná.
Plastový pavouk a sloučenina v malé trubici jsou příklady pro fosforescenci. Hlinitan strontnatý, který je obsažen v trubičce, je zpočátku excitován UV zářením a nakonec vyzařuje zelené světlo. Příčinou je dopování prvky, jako je europium, které činí sloučeninu použitelnou jako luminiscenční pigment .
Ohýbání svítící tyčinky (na pravé straně) iniciuje chemickou reakci mezi peroxidem vodíku a barvivem a fenyl oxalátem. Lze pozorovat chemiluminiscenci.
Video 1. Srovnání fluorescence, fosforescence a chemiluminiscence.
K. Arnold et al., Chemie Oberstufe (v němčině), Cornelsen Schulverlage, Berlin, 2015, 496-497. ISBN: 978-3-06-011179-4
Lexikon der Physik: Lumineszenz (v němčině), spektrum.de. (navštíveno 25. ledna 2017)
D. Wiechoczek, Wenn Mineralien selber leuchten – Phosphoreszenz, Fluoreszenz und Lumineszenz (v němčině), chemieunterricht.de 2010. (Přístup 25. ledna 2017)
Lexikon der Physik: Photophysikalische Prozesse (v němčině), spektrum.de. (navštíveno 27. ledna 2017)
D. Wiechoczek, Chemie mit Curry (v němčině), chemieunterricht.de 2015. (navštíveno 27. ledna 2017)
P. W. Atkins, J. de Paula, Kurzlehrbuch Physikalische Chemie (v němčině), Wiley-VCH, Weinheim, 2008, 853ff., 921ff. ISBN: 978-3-527-31807-0
P. W. Atkins, Physical Chemistry, Oxford University Press, 1994, 591ff.
Quantelung (v němčině), chemie.de. (navštíveno 27. ledna 2017)
Bohrův frekvenční vztah (v němčině), chemgapedia.de. (přístup 25. ledna 2017)
Technická univerzita Ilmenau, Praktický kurz Fyzikální chemie II: Fyzikální chemie/mikroreakční technologie, Fluorescenční zhášecí experiment (v němčině), tu-ilmenau.de. (navštíveno 27. ledna 2017)
Stokesův posun (v němčině), chemie.de. (navštíveno 25. ledna 2017)
Electron spin (v němčině), chemie.de. (navštíveno 27. ledna 2017)
Quantum yield (v němčině), chemie.de. (navštíveno 27. ledna 2017)
Špenát odhalil výbušniny v podzemních vodách (v němčině), Spiegel Online, 1. listopadu 2016. (přístup 27. ledna 2017)
D. Weiß, Phosphorescence (v němčině), chemie.uni-jena.de. (navštíveno 27. ledna 2017)
 Kim Dreier je studentkou střední školy Marianne-Weber-Gymnasium v německém Lemgu.
Kim Dreier je studentkou střední školy Marianne-Weber-Gymnasium v německém Lemgu.