Aspartátaminotransferáza podle Luka Spoonera
- 1 Funkce
- 2 Struktura
- 3 Funkce
- 4 Klinické aplikace
- 5 3D struktury aspartátaminotransferázy
.
Funkce
Aspartátaminotransferáza (AAT), známá také jako glutamát-asparagová transamináza, glutamát-oxaloctová transamináza, prefenátaminotransferáza a transamináza A je enzym, který patří do rodiny pyridoxalfosfát-dependentních aminotransferáz třídy I . Je kódována genem GOT1. Jedná se o homodimer dlouhý 413 aminokyselin, který hraje klíčovou roli v metabolismu aminokyselin a sacharidů, ureogenezi a přenosu redukčních ekvivalentů do mitochondrií a chloroplastů. V prokaryotických buňkách se nachází výhradně v cytosolu, ale v eukaryotických buňkách existují cytosolové, mitochondriální a chloroplastové izozymy. Bifunkční aspartátaminotransferáza (BAAT) je nezbytná pro transaminaci prefanátu na arogenát.
V lidském těle je produkována v mozku, kosterním svalstvu, játrech, slinivce břišní, červených krvinkách a ledvinách . Široké spektrum tkání, ve kterých se tvoří, ji odlišuje od podobného enzymu alanin-transaminázy (ALT), který se nachází především v játrech. Hladinu AAT v těle lze použít jako marker onemocnění nebo poškození tkání. Stejně tak lze porovnávat hladiny AAT a ALT, aby bylo možné určit, zda se poškození tkáně nachází především v játrech.
Struktura
, která obsahuje (alfa šroubovice, beta vlákna , smyčky , závity). Asymetrická jednotka aspartátaminotransferázy se zvýrazněnou malou a velkou doménou a kofaktorem PLP (1b4x). Každá podjednotka obsahuje ekvivalentní aktivní místo. Podjednotky se spojují na dvou místech: mezi svými velkými doménami a mezi N-koncovými zbytky a velkou doménou na druhé podjednotce. Tato struktura AST se u různých organismů od E. coli po člověka nepatrně liší. Stejně tak struktura aktivního místa je vysoce konzervovaná se sekvenční homologií 25 %.
Každá podjednotka homodimeru se dále dělí na malou a velkou doménu. Ta je tvořena aminokyselinami od N-konce po zbytek Pro 48 a od Met 326 po C-konec. Zbývající aminokyseliny tvoří , a ty jsou spojeny dlouhou α-šroubovicí sestávající z 32 aminokyselin.
Velká doména je místem, kde se nachází aktivní místo AAT, a aby se mu přizpůsobilo, obsahuje jádro mnoho α/β supersekundárních struktur. To je v kontrastu s jádrem malé podjednotky, které je tvořeno dvěma α-helixy a dvěma β-řetězci. U mnohobuněčných organismů se na 325. zbytku nachází zalomení, které funguje jako kloub malé domény, což umožňuje výsledné konformační změny, k nimž dochází při vazbě inhibitorů na enzym.
Jak bylo uvedeno výše, aktivní místo AST se nachází na velké doméně podjednotky. V aktivním místě se nachází amino zbytek Lys 258, známý také jako vnitřní aldimin, který se váže s kofaktorem pyridoxal 5′-fosfátem () a vytváří tzv. schiffovu bázi. Po přidání substrátu aminokyseliny se mezi PLP a aminokyselinou vytvoří nová Schiffova báze.
Funkce
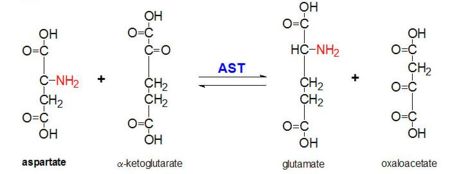
Obrázek 2: Transaminační reakce L-aspartátu a α-ketoglutarátu katalyzovaná aspartátaminotransferázou
AAT katalyzuje reverzibilní transaminaci α-amino skupiny z L-aspartátu na α-ketoglutarát za vzniku oxaloacetátu a glutamátu. Tato reaktivita je u E.coli nižší než u vyšších eukaryot a má širší substrátovou specifitu. Reakce však probíhá stejným způsobem. Po zavedení aminokyselinového substrátu se mezi ním a kofaktorem PLP vytvoří nová Schiffova báze. To způsobí, že aminokyselina ztratí vodík a vytvoří meziprodukt chinoid a dojde k reprotanaci, jejímž výsledkem je ketimin. Poté se struktura hydrolyzuje za vzniku kyseliny α-keto a pyridoxaminfosfátu. 2-methyl aspartát působí jako inhibitor AAT, když s kofaktorem PLP tvoří spíše Schiifovu bázi než aspartát. To má za následek, že se proces zastaví v kroku před vyloučením alfa proteinu.
Tato reakce je nezbytná pro udržení homeostázy v organismech. Čtyři různé molekuly, které mohou vzniknout v důsledku této transanimace (oxaloacetát, α-ketoglutarát, aspartát, L-glutamát), jsou pro řadu metabolických procesů kritické. Oxaloacetát a α-ketoglutarát hrají klíčovou roli v Krebsově cyklu, různé formy aspartátu jsou důležitými molekulami v cyklu močoviny a podílejí se na glukoneogenezi a glutamát je důležitou molekulou v metabolických drahách spojených s pamětí.
Klinické aplikace
Hladiny AAT v těle ukazují na poškození tkání a onemocnění. Za normálních okolností se AAT v krvi vyskytuje v minimálním množství, avšak při poškození výše uvedených orgánů se AAT do krve uvolňuje. Uvolněné množství je úměrné míře utrpěného poškození. Bylo prokázáno, že hladina AAT se výrazně zvýší do 6 hodin od počátečního poškození tkáně a může zůstat zvýšená až 4 dny. Porovnáním hladin AAT s hladinami jiných enzymů mohou lékaři určit, kde v těle došlo k poškození. Srovnání s ALT se ukázalo jako zvláště užitečné při identifikaci poškození jater, jako je cirhóza a hepatitida. Za normálního stavu je hladina AAT u mužů 6-34 IU/l a u žen 8-40 IU/l.
3D struktury aspartátaminotransferázy
3D struktury aspartátaminotransferázy
.