Popis chemických reakcí
V této kapitole se seznámíme s některými reakcemi, v nichž klíčové kroky zahrnují pohyb jednotlivých elektronů. Možná si vzpomenete na kapitolu 6.1A, že pohyb jednoho elektronu je znázorněn šipkou s jedním háčkem (na rozdíl od známých šipek s dvěma háčky, které jsme používali v celé knize pro znázornění pohybu dvou elektronů).

Jednoelektronové mechanismy zahrnují vznik a následnou reakci volných radikálů, vysoce nestabilních meziproduktů, které obsahují nespárovaný elektron. V této kapitole se dozvíme, jak volné radikály často vznikají při homolytickém štěpení, což je děj, při němž se oba elektrony v rozbíjející se kovalentní vazbě pohybují v opačných směrech

(Naproti tomu v podstatě všechny reakce, které jsme dosud studovali, zahrnují děje rozbíjející vazbu, při nichž se oba elektrony pohybují ve stejném směru: tomu se říká heterolytické štěpení).
Dozvíme se také, že mnoho jednoelektronových mechanismů má podobu radikálové řetězové reakce, v níž jeden radikál způsobí vznik druhého radikálu, který zase způsobí vznik třetího radikálu atd.
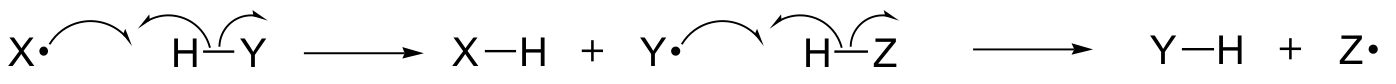
Vysoká reaktivita volných radikálů a jejich schopnost iniciovat řetězové reakce je často výhodná – v této kapitole se dozvíme o radikálových polymeračních reakcích, při nichž vznikají užitečné materiály, jako je plexisklo a polyproylenová tkanina. Dozvíme se také o radikálových reakcích, které jsou škodlivé, jako je rozklad atmosférického ozonu freonem a oxidační poškození lipidů a DNA v našem těle volnými radikály. Nakonec uvidíme, jak některé enzymy využívají vázané kovy ke katalýze vysokých e
Geometrie a relativní stabilita uhlíkových radikálů
Jako organické chemiky nás zajímají zejména radikálové meziprodukty, v nichž se nespárovaný elektron nachází na atomu uhlíku. Experimentální důkazy ukazují, že tři vazby v uhlíkovém radikálu mají trigonální planární geometrii, a proto se uhlík považuje za sp2-hybridizovaný s nepárovým elektronem zaujímajícím kolmý, nehybridizovaný 2pzorbital. Tento obraz kontrastuje s karbokačními a karbaniontovými meziprodukty, které jsou rovněž trigonálně planární, ale jejichž 2pz orbitaly obsahují nula, resp. dva elektrony.

Tendence ve stabilitě uhlíkových radikálů je paralelní se stabilitou karbokací (oddíl 8.4B): například terciární radikály jsou stabilnější než sekundární radikály, následují primární a methylové radikály. To by mělo dávat intuitivní smysl, protože radikály, stejně jako karbokationty, lze považovat za elektronově deficitní, a proto jsou stabilizovány elektronově donujícími účinky blízkých alkylových skupin. Benzylové a alkylové radikály jsou stabilnější než alkylové radikály díky rezonančním efektům – nepárový elektron může být delokalizován přes systém konjugovaných vazeb pí. Například allylový radikál si lze představit jako systém tří paralelních 2pz orbitalů sdílejících tři elektrony.
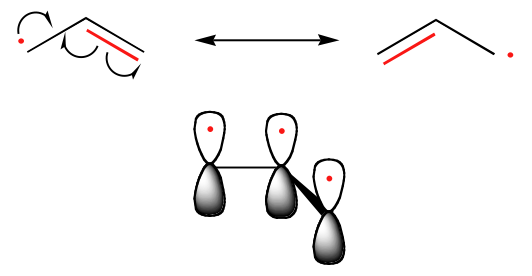
Trendy ve stabilitě radikálů
Allyová & Benzolová > 3o > 2o > 1o > Methylová

V této molekule je již tak rozsáhlá rezonanční stabilizace dále posílena schopností atomů chloru chránit radikálové centrum před vnějšími činidly. Radikál je v jistém smyslu uvnitř ochranné „klece“.
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)
-
Prof. Steven Farmer (Sonoma State University)
- Layne A. Morsch (University of Illinois Springfield)
.