I föregående avsnitt visas hur olika grundämnen antingen kan existera ensamma eller kombineras med andra grundämnen för att skapa föreningar. Det här avsnittet bygger vidare på dessa idéer genom att titta närmare på kemiska reaktioner. Det visar också hur kemiska förkortningar kan utvidgas till att beskriva kemiska reaktioner.
Först ska vi betrakta några av de molekyler som beskrivits tidigare: vatten, metan, koldioxid och ammoniak.
Fråga 26
Vilka formler finns det för var och en av dessa fyra molekyler?
Svar
Formlerna är H2O, CH4, CO2 respektive NH3.
Och även om du inte behöver komma ihåg de kemiska formlerna för de föreningar som introduceras i den här kursen kommer du förmodligen att tycka att det är användbart att memorera några, t.ex. formlerna för de fyra molekylerna ovan, samt formlerna för väte- (H2), kväve- (N2) och syre- (O2) molekyler. Detta kommer att hjälpa dig att läsa och skriva dessa kemiska formler utan att ständigt hänvisa tillbaka till tidigare avsnitt.
Nu kommer du att titta på reaktioner som involverar grundämnena väte, kol och syre och föreningarna metan, vatten och koldioxid.
Väte reagerar med syre när det antänds (det är ganska explosivt) för att bilda vatten. För att skriva en sådan reaktion i form av en kemisk ekvation sätts de ämnen som genomgår reaktionen till vänster och de ämnen som bildas vid reaktionen till höger. Reaktanterna till vänster kopplas till produkterna till höger med en pil.
Ekvationen kan skrivas som en ordekvation ”väte och syre bildar vatten” eller, med hjälp av lite kemisk stenografi, kan den skrivas som:

där pilen betyder ”går till”.
Prova nu att använda kemisk stenografi för att skriva ekvationen. Genom att ersätta symbolerna i ordet ekvation får man:

Ekvationen visar att reaktanterna till vänster om pilen omvandlas till produkten till höger. Det är dock något som är fel med denna ekvation. Du kan se vad som är fel genom att titta på figur 21 där reaktanterna och produkterna visas som ett diagram.
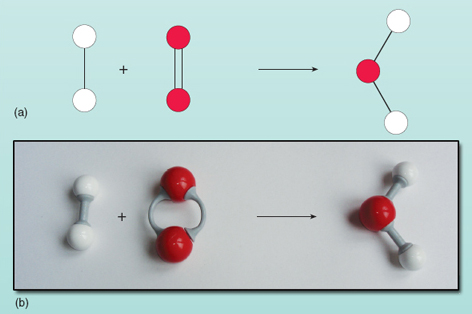
Om man räknar antalet atomer på varje sida av ekvationen visar det sig att det finns två syreatomer till vänster jämfört med en till höger. Antalet syreatomer på båda sidor av ekvationen måste vara lika många – de kan inte magiskt dyka upp och försvinna under en reaktion. Det är inte möjligt att ändra sammansättningen av vattenmolekylen till höger i ekvationen eftersom vattenmolekylen existerar som en grupp av två väteatomer och en syreatom som alla är bundna till varandra. Varje syremolekyl levererar två syreatomer och kommer därför alltid att bilda två vattenmolekyler, förutsatt att det finns två vätemolekyler (som var och en består av två atomer) som kan reagera med den. Det behövs alltså två väte- och en syremolekyl för att bilda två vattenmolekyler. Reaktionen uttrycks korrekt genom:

Det finns nu samma antal av varje typ av atom på båda sidor av ekvationen: den kemiska ekvationen är balanserad, så vi kan nu ersätta pilen med ett likhetstecken.
En sista justering för att undvika att upprepa vätgasmolekylerna till vänster om ekvationen och vattenmolekylerna till höger är att representera dem med 2H2 istället för H2 + H2. Så den balanserade kemiska ekvationen blir:

Detta visas schematiskt i figur 22.

Kemiska ekvationer visar på ett mycket kortfattat sätt inte bara vilka atomer och molekyler som reagerar tillsammans för att bilda produkterna, utan också hur många av varje typ av atomer och molekyler som är inblandade. Det är viktigt att komma ihåg att siffran före en molekyl betyder antalet av just den molekylen. Till exempel betyder 3H2O tre vattenmolekyler, vilket ger totalt sex väte- och tre syreatomer.
Kemiska ekvationer måste vara i balans; antalet atomer av varje typ av grundämne på båda sidor av ekvationen måste vara lika många.
Du vet nu hur man ”läser” eller tolkar en kemisk ekvation – och hur den representerar en kemisk process. Kemister är dock också mycket skickliga på att skriva kemiska ekvationer som en form av stenografi för att beskriva olika kemiska processer eller reaktioner. Att skriva kemiska ekvationer är som att skriva ett främmande språk – det krävs övning för att bli flytande. Alla nyblivna vetenskapsmän måste dock börja någonstans, och i avsnittet nedan visas hur man gör detta med hjälp av en mycket välkänd kemisk reaktion. Om du vill kontrollera om du behöver studera det här avsnittet kan du prova fråga 20 först.