Har du någonsin funderat på varför glödpinnar (se fig. 1) lyser efter att du har böjt dem? Eller varför de där plaststjärnorna fortfarande lyser på natten efter att ljuset har släckts? Det har du kanske inte gjort. Men oavsett om du har ställt dig dessa frågor eller inte kommer följande text förhoppningsvis att ge dig svar och förklaringar till fenomenen med lysande armband, lysande maneter, svart ljus och många fler.

Figur 1. Glödpinnar.
Luminescens
I allmänhet kallas det glöd som uppstår i alla ovan nämnda fenomen för luminescens. Luminescens är energi som frigörs av ett ämne i form av ljus . Flera typer av luminescens kan särskiljas:
- Ett exempel är kemiluminescens. Under vissa kemiska reaktioner frigörs energi i form av ljus. Detta sker efter att man böjt en glödpinne. Det är också orsaken till att djur som maneter och vissa mikroorganismer lyser. I detta fall kallas det bioluminescens .
- En annan typ är triboluminescens. Denna kan observeras när ett självhäftande kuvert öppnas i fullständigt mörker eller när självhäftande tejp rullas ut i ett mörkt rum. Genom att göra detta förs mekanisk energi in i systemet och fungerar som en aktivator för glöden .
- Den troligen mest kända typen av luminescens är fotoluminescens. Här tillförs energi genom elektromagnetisk strålning, till exempel genom solljus eller en ultraviolett lampa, som i vissa diskotek. Detta orsakar fenomen som det ständiga glöden från plaststjärnor eller den extrema ljusstyrkan hos vita kläder under svart ljus. Man kan skilja på fluorescens och fosforescens, vilket kommer att förklaras nedan .
Vad är ett elektroniskt exciterat tillstånd?
Generellt sett bygger alla typer av luminescens på så kallade fotofysiska processer. Vanligtvis beskrivs själva molekylerna som fluorescerande. Detta är fallet med fluorescerande färgämnen som fluorescein eller curcumin . För att förklara fotofysiska processer måste man dock titta närmare på en ännu mindre nivå än den molekylära.
Atomer från olika grundämnen har olika antal elektroner fördelade på flera skal och orbitaler. Elektroner är en typ av elementarpartiklar. Elektroniska övergångar är ansvariga för luminescens . När systemet absorberar energi exciteras elektronerna och lyfts till ett högre energitillstånd. Före excitationen, i grundtillståndet, befinner sig en del av elektronerna i den så kallade HOMO (Highest Occupied Molecular Orbital). Efter att de nått ett exciterat tillstånd befinner de sig i LUMO (Lowest Unoccupied Molecular Orbital) (se figur 2). Hur detta fungerar exakt kommer att förklaras med fotoluminescens som ett specifikt exempel.

Figur 2. Elektronisk excitation.
Differenta energitillstånd hos en atom eller molekyl kallas ”energinivåer”. Beroende på molekyl och atom kan elektronerna endast inta diskreta energinivåer eftersom energin är kvantiserad, vilket innebär att energi endast kan absorberas och avges i vissa mängder . Skillnaden mellan två nivåer kan beräknas med ekvation 1 (där E2 är den högre energinivån och E1 den lägre).
(1) ΔE = E2-E1
Photoner, partiklar som elektromagnetisk strålning eller ljus består av, måste ha ett visst energivärde för att kunna excitera elektroner. Energin hos en foton kan beräknas med ekvation 2, där h är Planckkonstanten och ν är ljusets frekvens.
(2) Ephoton = hν
Den nödvändiga excitationsenergin för elektronerna är lika med skillnaden mellan energinivåerna. Endast ljus med en viss energi, och följaktligen med en viss frekvens och våglängd, kan excitera elektroner . Genom att jämföra ekvationerna 1 och 2 och med hjälp av ekvation 3 (där c står för ljusets hastighet) kan den nödvändiga frekvensen och våglängden beräknas (se ekvation 4) . I många fall används UV-strålning för excitering.
(3) λ = c/ν
(4) ΔE = Ephoton ⇔ E2 – E1 = hν
ν = (E2 – E1)/h
λ = hc/(E2 – E1)
Deaktivering av elektroniskt exciterade tillstånd
Sådana elektroniskt exciterade tillstånd är instabila. Elektroner faller tillbaka till sina grundtillstånd. Samtidigt frigörs excitationsenergin igen. Man skiljer mellan radiativa och icke-radiativa sönderfallsprocesser. För det mesta är sönderfallet icke-strålande, till exempel genom vibrationsrelaxation, släckning med omgivande molekyler eller intern omvandling (IC) . Dessa processer kommer att förklaras i detalj senare.
Undertiden kan ett strålande sönderfall ske i form av fluorescens och fosforescens. Energin avges som elektromagnetisk strålning eller fotoner. Det emitterade ljuset har en längre våglängd och en lägre energi än det absorberade ljuset eftersom en del av energin redan har frigjorts i en icke-strålande sönderfallsprocess . Detta är anledningen till att en emission i det synliga spektrumet kan uppnås genom excitering med icke synlig UV-strålning. Denna förskjutning mot en längre våglängd kallas Stokes-förskjutning .
Jämförelse: Fluorescens vs. fosforescens
Både fluorescens och fosforescens är spontana emissioner av elektromagnetisk strålning. Skillnaden är att fluorescensens glöd upphör direkt efter att källan till excitatorisk strålning har stängts av, medan det för fosforescens kan uppstå ett efterglöd med varaktigheter på bråkdelar av en sekund upp till timmar .
För att kunna jämföra de fotofysiska processerna bakom de båda fenomenen finns det några fakta om elektroner som är till hjälp för förståelsen: Elektroner är partiklar som har ett så kallat spinn och ett spinkvantnummer. Detta kan ha två olika värden, nämligen antingen +1/2 eller -1/2 . Detta tal är en egenskap som vi faktiskt inte kan föreställa oss eller beskriva enkelt. Det jämförs ofta med en snurrande topp, som antingen snurrar med eller moturs. Denna beskrivning är dock varken matematiskt eller fysikaliskt helt korrekt. Två elektroner i ett enda orbital i en atom har antiparallellt spinn, vilket noteras som (↓) .
Fluorescens
I Jablonski-diagrammet för fluorescens (se fig. 3) är singelspinntillståndet S0 elektronernas grundtillstånd, och S1 och S2 är singelspinntillstånden exciterade tillstånd (tillstånden används endast som exempel i den här texten och gäller inte nödvändigtvis vissa atomer, molekyler etc.). Inom dessa tillstånd finns det flera energinivåer. Ju högre nivån är, desto mer energi har en elektron när den befinner sig på den nivån. När det gäller singuletttillstånd har elektronerna antiparallella spins.

Figur 3. Jablonski-diagram för fluorescens.
Elektronerna lyfts från grundtillståndet S0 till exempel till en energinivå i det andra exciterade tillståndet S2 när de exciteras av elektromagnetisk strålning. När exciteringen upphör stannar elektronerna endast en kort tid (ca 10-15 s) i det exciterade tillståndet och börjar sedan omedelbart falla tillbaka till grundtillståndet . Därigenom kan energi initialt frigöras till omgivningen genom vibrationsrelaxation. Det innebär att termisk energi frigörs genom atomens eller molekylens rörelse tills den lägsta nivån i det andra exciterade tillståndet nås.
Den större klyftan mellan det andra och det första exciterade tillståndet övervinns genom intern omvandling. Det beskriver en elektronisk övergång mellan två tillstånd samtidigt som elektronernas spinn bibehålls. Nu kan elektronerna slappna av ytterligare på grund av mer vibrationsrelaxation tills de når den lägsta energinivån i S1-tillståndet.
Teoretiskt sett skulle elektronerna kunna slappna av ännu mer på ett icke-strålande sätt tills de slutligen når grundtillståndet igen. Det kan dock vara så att den sista energimängden är för stor för att avges till omgivningen eftersom de omgivande molekylerna inte kan absorbera så mycket energi. Då uppstår fluorescens, vilket leder till en emission av fotoner med en viss våglängd. Emissionen varar bara tills elektronerna är tillbaka i grundtillståndet. Eftersom elektronernas spinn hålls oförändrat under alla dessa övergångar, beskrivs de som spinn-tillåtna.
Fosforescens
För fosforescens är saker och ting lite annorlunda (se fig. 4). Det finns återigen ett S0-grundtillstånd och de två exciterade tillstånden S1 och S2. Dessutom finns det ett exciterat tripletttillstånd T1 som energimässigt ligger mellan S0- och S1-tillståndet. Elektronerna har återigen antiparallella spins i grundtillståndet.
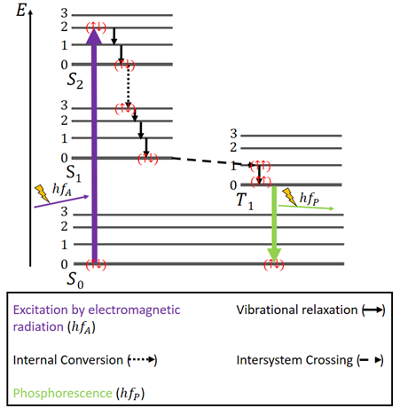
Figur 4. Jablonski-diagram för fosforescens.
Excitering sker på samma sätt som vid fluorescens, nämligen genom elektromagnetisk strålning. Frigörandet av energi genom vibrationsrelaxation och intern omvandling med bibehållande av samma spinn sker även här på samma sätt, men endast tills S1-tillståndet är uppnått.
När singuletttillstånden existerar ett tripletttillstånd och s.k. intersystem crossing (ISC) kan förekomma, eftersom T1-tillståndet är energetiskt sett mer gynnsamt än S1-tillståndet. Denna crossing är liksom intern omvandling en elektronisk övergång mellan två exciterade tillstånd. Men till skillnad från intern omvandling är ISC förknippad med en spinnvändning från singlet till triplett. Elektroner i tripletttillståndet har parallella spinn, vilket noteras som () . Denna ISC-process beskrivs som ”spinnförbjuden”. Den är inte helt omöjlig – på grund av ett fenomen som kallas ”spin-orbitkoppling” – men den är dock ganska osannolik .
I T1-tillståndet är icke-radiativt sönderfall också möjligt. En övergång mellan tripletttillståndets lägsta energinivå och S0-tillståndet är dock inte utan vidare möjlig, eftersom den övergången också är spinnförbjuden. Ändå kan det hända ändå med en liten möjlighet. Det orsakar en ganska svag emission av fotoner eftersom elektronspinnet måste vändas om igen. Energin är fångad i detta tillstånd ett tag och kan bara frigöras långsamt . När all energi har frigjorts är elektronerna tillbaka i grundtillståndet.
Slutsats
De spinntillåtna och spinnförbjudna processerna tjänar som förklaringar till ett omedelbart upphörande sken av fluorescens och till efterskenet av fosforescens. Fosforescens uppträder vanligtvis endast med ”tyngre” molekyler eftersom spinnet måste vändas med hjälp av spin-orbit-koppling. Huruvida elektromagnetisk strålning överhuvudtaget sänds ut och med vilken våglängd beror på hur mycket energi som kan frigöras i förväg genom icke-strålande sönderfall . Det beror också på egenskaperna hos så kallade quenchers som är omgivande molekyler och som kan ta upp större mängder energi.
Alla processer som kan leda till en hämning av radiativa sönderfall kan orsaka fluorescensdämpning. Exempel är icke-strålande sönderfallsprocesser, men även förstörelse av den fluorescerande molekylen . Kvanteffektiviteten beskriver processens effektivitet och definieras som förhållandet mellan absorberade och emitterade fotoner . Denna egenskap är olika för varje ämne.
Även om denna text fokuserar på fotoluminescens är de fotofysiska processerna desamma för alla typer av luminescens .
Tillämpningar
Förutom produkter som glödlampor används fluorescens och fosforescens på många andra sätt. Ytterligare exempel är vägvisare som leder till en nödutgång och som inte behöver någon elförsörjning men som lyser på natten på grund av fosforescens. Även växter kan göras fluorescerande: Spenat kan modifieras med hjälp av nanoteknik så att den kan upptäcka spår av explosiva ämnen i grundvattnet. Bladen innehåller kolnanorör till vilka nitroaromatiska ämnen kan bindas. Om de gör det frigörs en fluorescerande signal av växten som kan upptäckas med infraröda kameror .
Videon visar olika typer av luminescens. På vänster sida visas fluorescensen av färgämnet curcumin, som ingår i kryddan gurkmeja, under UV-ljus . Kurkumin löses upp i alkohol för att göra fluorescensen synlig.
Plastspindeln och föreningen i det lilla röret är exempel på fosforescens. Strontiumaluminat, som finns i röret, exciteras inledningsvis av UV-strålning och avger så småningom grönt ljus. Orsaken till detta är en dopning med grundämnen som europium, vilket gör föreningen användbar som ett självlysande pigment .
Böjning av glödpinnen (till höger) initierar en kemisk reaktion mellan väteperoxid och ett färgämne och fenyloxalat. Kemiluminescens kan observeras.
Video 1. Fluorescens, fosforescens och kemiluminiscens i jämförelse.
K. Arnold et al., Chemie Oberstufe (på tyska), Cornelsen Schulverlage, Berlin, 2015, 496-497. ISBN: 978-3-06-011179-4
Lexikon der Physik: Lumineszenz (på tyska), spektrum.de. (besökt den 25 januari 2017)
D. Wiechoczek, Wenn Mineralien selber leuchten – Phosphoreszenz, Fluoreszenz und Lumineszenz (på tyska), chemieunterricht.de 2010. (Tillgänglig den 25 januari 2017)
Lexikon der Physik: Photophysikalische Prozesse (på tyska), spektrum.de. (besökt den 27 januari 2017)
D. Wiechoczek, Chemie mit Curry (på tyska), chemieunterricht.de 2015. (besökt den 27 januari 2017)
P. W. Atkins, J. de Paula, Kurzlehrbuch Physikalische Chemie (på tyska), Wiley-VCH, Weinheim, 2008, 853ff., 921ff. ISBN: 978-3-527-31807-0
P. W. Atkins, Physical Chemistry, Oxford University Press, 1994, 591ff.
Quantelung (på tyska), chemie.de. (besökt 27 januari 2017)
Bohrs frekvensrelation (på tyska), chemgapedia.de. (besökt den 25 januari 2017)
Ilmenau tekniska universitet, Praktisk kurs Fysikalisk kemi II: Fysikalisk kemi/Mikroreaktionsteknik, Fluorescensavsläckningsförsök (på tyska), tu-ilmenau.de. (besökt 27 januari 2017)
Stokes skift (på tyska), chemie.de. (besökt 25 januari 2017)
Elektronspin (på tyska), chemie.de. (besökt 27 januari 2017)
Quantum yield (på tyska), chemie.de. (tillgänglig från 27 januari 2017)
Spenat upptäcker sprängämnen i grundvattnet (på tyska), Spiegel Online, 1 november 2016. (besökt 27 januari 2017)
D. Weiß, Phosphorescence (på tyska), chemie.uni-jena.de. (tillgänglig från den 27 januari 2017)
 Kim Dreier är elev på Marianne-Weber-Gymnasium i Lemgo, Tyskland.
Kim Dreier är elev på Marianne-Weber-Gymnasium i Lemgo, Tyskland.