Svaveltrioxid Kemiska egenskaper, användning, produktion
Kemiska egenskaper
Svaveltrioxid, S03, även känd som svavelsyraanhydrid, nålar eller polymer, existerar i ett antal modifikationer som skiljer sig åt i molekylär art och kristallin form. Den har en vit, isliknande modifikation som smälter vid 16 °C (61 °F) och två andra som bestosliknande former som smälter vid de högre temperaturerna 33 och 62 °C (90 och 144 °F). Den färglösa vätske- eller gasformen har irriterande, giftiga ångor och kokar vid 45 °C (112 °F).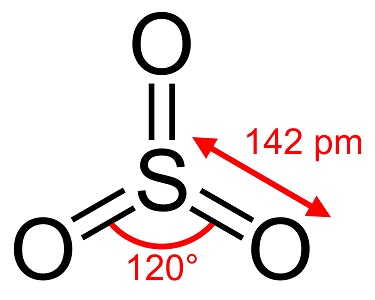
Svaveltrioxid är ett mycket reaktivt ämne, ett starkt oxidationsmedel och en brandrisk. Den reagerar med metalloxider för att bilda sulfater och med vatten för att bilda svavelsyra. Svaveltrioxid används för sulfonering.
Fysikaliska egenskaper
Färglös vätska vid omgivande temperatur och atmosfäriskt tryck; ångor i luft.
Svaveltrioxid tenderar att polymerisera, särskilt i närvaro av spår av vatten eller svavelsyra. Polymerisationshastigheten minskar dock kraftigt när dess fryspunkt närmar sig. Fast (polymer) svaveltrioxid finns i tre polymorfa faser: alfa-, beta- och gammamodifieringar.
Alfafasen består av isliknande nålar med polymer tvärbunden struktur. Den smälter vid 62,3 °C och har ett ångtryck på 73 torr vid 25 °C.
Betafasen är en metastabil allotrop med vita, asbestliknande, glänsande nålar som består av polymera molekyler, smälter vid 32,5 °C och har ett ångtryck på 344 torr vid 25 °C.
Gamamamodifieringen kan vid vanliga temperaturer finnas i fast eller flytande form. I fast form är den en kolloidal isliknande massa som smälter vid 16,8°C. I flytande form har den en densitet på 1,9224 g/mL och kokar vid 44,8°C. Det har ett ångtryck på 433 torr vid 25 °C. Gammafasen består av både cykliska trimer- och monomermolekyler. När fast svaveltrioxid smälter övergår den till sin gammafas som vid stelning övergår till alfamodifiering.
Kritisk temperatur för SO3 är 217,8°C; kritiskt tryck 80,97 atm; kritisk densitet 0,63 g/cm3; dielektricitetskonstanten för flytande SO3 vid 18°C är 3,11.
Svaveltrioxid löser sig i vatten och bildar svavelsyra med stor värmeutveckling.
Användningar
Svaveltrioxid används som mellanprodukt vid framställning av svavelsyra och oleum för sulfonering, särskilt av färgämnen och färgämnen, samt vid framställning av vattenfri salpetersyra och sprängämnen. Fast svaveltrioxid saluförs under namnen Sulphan och Triosul och används främst för sulfonering av organiska syror. Svaveltetrafluorid är ett fluoreringsmedel. Svavelhexafluorid fungerar som en gasformig isolator i elektriska högspänningsanläggningar. Sulfyrylfluorid används som insekticid och fumigant.
Sulfonering av organiska föreningar, särskilt icke-joniska tvättmedel, solfångare. Den framställs vanligen i den anläggning där den ska användas.
Produktionsmetoder
Svaveltrioxid framställs som en mellanprodukt vid framställning av svavelsyra genom kontaktprocessen (se Svavelsyra). Processen innebär katalytisk oxidation av svaveldioxid till trioxid.
Svaveltrioxid framställs i laboratoriet genom upphettning av rykande svavelsyra, kondensering av dess ångor och uppsamling i en kall behållare. När ångorna kondenseras under 27 °C i närvaro av spår av fukt bildas alla tre polymorfa faser av SO3. De kan separeras genom fraktionerad destillation. Kondensering av ångorna över 27 °C bildar den flytande varianten av gamma-svaveltrioxid.
Allmän beskrivning
Svaveltrioxid är ett färglöst till vitt kristallint fast ämne som rökar i luft. Levereras ofta med inhibitor för att förhindra polymerisering. Svaveltrioxid reagerar våldsamt med vatten och bildar svavelsyra med avgivande av värme. Svaveltrioxid är frätande för metaller och vävnad. Svaveltrioxid orsakar ögon- och hudbrännskador. Intag orsakar allvarliga brännskador i munnen matstrupen och magsäcken. Ångan är mycket giftig vid inandning. Svaveltrioxid utgör en brandrisk vid kontakt med organiska material som trä, bomull, fiberskivor osv.
Luft &Vatten Reaktioner
Kombineras med vatten med explosiv kraft och bildar svavelsyra på grund av sin surhet Svaveltrioxid kilar de flesta organiska ämnen. Vid exponering för luft absorberar svaveltrioxid snabbt fukt och avger täta vita rökgaser .
Reaktivitetsprofil
Reaktionen mellan svaveltrioxid och syrendifluorid är mycket kraftig och explosioner uppstår om reaktionen utförs i avsaknad av ett lösningsmedel . Reaktionen av svaveltrioxid i överskott med tetrafluoreten orsakar explosiv nedbrytning till karbonylfluorid och svaveldioxid . Reaktionen av vattenfri perklorsyra med svaveltrioxid är våldsam och åtföljs av betydande värmeutveckling (Pascal 16:300 1931-34). Flytande svaveltrioxid reagerar våldsamt med nitrylklorid, även vid 75° C. Reaktionen mellan svaveltrioxid och blyoxid ger upphov till vit luminescens. Kombinationen av jod, pyridin, svaveltrioxid och formamid utvecklade en gas övertryck efter flera månader. Detta beror på den långsamma bildningen av svavelsyra, från externt vatten eller dehydrering av formamid till vätecyanid.
Faror
Oxidationsmedel, brandrisk vid kontakt medorganiska material, en explosiv ökning av ångtrycket uppstår när α-formen smälter. Anhydridetkombineras med vatten och bildar svavelsyra och utvecklar värme. Mycket giftigt, starkt irriterande för vävnaden.
Hälsofara
Svaveltrioxid är mycket giftig. Den är irriterande och frätande för slemhinnor. Giftigt vid inandning eller sväljning. Kontakt orsakar allvarliga brännskador på hud och ögon.
Brandfarlighet
Brandrisk vid kontakt med organiska material. En explosiv ökning av ångtrycket uppstår när alfaformen smälter. Kombinerar med vatten med explosivt våld och bildar svavelsyra. Kan antända andra brännbara material (trä, papper, olja etc.). Brandfarliga giftiga gaser kan ansamlas i tankar och trattvagnar. Avrinning till avloppet kan skapa brand- eller explosionsrisk. Bildar svavelsyra vid kontakt med vatten. Undvik vatten och organiska material. Vid exponering i luften absorberar svaveltrioxid fukt och avger täta vita rökgaser.
Säkerhetsprofil
Gift vid inandning. Människans systemiska effekter vid inandning: Hosta och andra lung- och luktförändringar. Frätande irriterande för hud, ögon och slemhinnor. Våldsam reaktion med O2F2, PbO, NClO2, HClO4, P, tetrafluoreten, acetonitril, svavelsyra, dimetylsulfoxid, dioxan, vatten, difenylkvicksilver, formamid, jod, pyridin, metalloxider. Reagerar med ånga och bildar frätande, giftiga ångor av svavelsyra. Vid upphettning till nedbrytning avger den giftiga ångor av SO,. Se även Svavelsyra.
Potentiell exponering
Svaveltrioxid används som sulfaterings- och sulfonateringsmedel för tvättmedel, tillsatser till smörjolja och andra organiska föreningar samt i solfångare. Den används också som mellanprodukt vid framställning av svavelsyra och vid tillverkning av sprängämnen.
lagring
Svaveltrioxidens ångtryck stiger snabbt med stigande temperatur, och när α-formen smälter är tryckökningen explosiv. Transport- och lagringsbehållare måste därför tåla ett tryck på 10-15 atm. Svaveltrioxid reagerar kraftigt och starkt exotermiskt med vatten för att producera svavelsyra. När den utsätts för fuktig luft bildar den ångor och en dimma av svavelsyra som så småningom fyller hela det tillgängliga utrymmet och även fräter metaller. Det är ett kraftfullt oxidationsmedel och i vätskefasen förkolnar det organiska material.
Skeppning
UN1829 Svaveltrioxid, stabiliserad, Faroklass: 8; Etiketter:
Inkompatibiliteter
Brännbart och frätande. Ett starkt oxidationsmedel. Reagerar våldsamt med vatten, ånga eller fukt och frigör frätande svavelsyra. Våldsamma reaktioner uppstår vid kontakt med starka baser; starka syror, kemiskt aktiva metaller; reduktionsmedel; finfördelad metall; cyanider, nitrater, pikrater, fulminater, klorater, sulfider, karbider, fosfor, dioxiddifluorid, bariumoxid; blyoxid; difenylkvicksilver; alkoholer, nitrylklorid; acetonitril, dioxan, tetrafluoretylen.
Avfallshantering
Återlämna påfyllningsbara tryckgasflaskor till leverantören. Icke påfyllningsbara flaskor ska bortskaffas i enlighet med lokala, statliga och federala bestämmelser. Låt den återstående gasen sakta ventileras ut i atmosfären i ett oavgränsat område eller i en avluftningshuva. Återfyllningsbara flaskor ska returneras till den ursprungliga leverantören med eventuella ventilkapslar och utloppspluggar säkrade och med ventilskyddslock på plats.