Denna struktur uppstår när två (eller flera, t.ex. ψ-slinga) segment av en polypeptidkedja överlappar varandra och bildar en rad av vätebindningar med varandra. Detta kan ske i ett parallellt arrangemang:

Och i ett antiparallellt arrangemang:
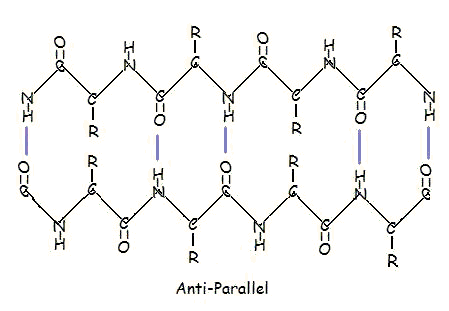
Parallellt och antiparallellt arrangemang är en direkt följd av polypeptidkedjans riktning. Vid antiparallellt arrangemang är C-terminusändan av ett segment på samma sida som N-terminusändan av det andra segmentet. I ett parallellt arrangemang är C-terminusändan och N-terminusändan på samma sida för båda segmenten. ”Plisseet” uppstår på grund av de alternerande planen för peptidbindningarna mellan aminosyrorna; den justerade amino- och karbonylgruppen i varje motsatt segment alternerar sin orientering från att vara vänd mot varandra till att vara vänd åt motsatt håll.
Det parallella arrangemanget är mindre stabilt eftersom geometrin hos de enskilda aminosyramolekylerna tvingar vätebindningarna att uppstå i en vinkel, vilket gör dem längre och därmed svagare. I det antiparallella arrangemanget däremot är vätebindningarna riktade rakt emot varandra, vilket ger starkare och stabilare bindningar.
Sedvanligt nog bildas ett antiparallellt beta-pleat ark när en polypeptidkedja kraftigt vänder riktning. Detta kan ske i närvaro av två på varandra följande prolinrester, som skapar en vinklad knut i polypeptidkedjan och böjer den tillbaka på sig själv. Detta är inte nödvändigt för avlägsna segment av en polypeptidkedja för att bilda beta-plisserade ark, men för proximala segment är det ett definitivt krav. På korta avstånd är de två segmenten i ett beta-plisserat ark åtskilda av 4+2n aminosyrarester, där 4 är det minsta antalet rester.