Introduktion
Den mänskliga hjärnan genomgår en omfattande mognad under hela livet för att underlätta den kognitiva utvecklingen. Myeliniseringen av axoner i hela nervsystemet är en sådan avgörande mognadsprocess. I det centrala nervsystemet (CNS) sträcker gliaceller som kallas oligodendrocyter ut många processer i sin omgivande miljö, som koncentriskt lindar membran runt axoner för att bilda myelinskidor. Myelinskeden möjliggör snabb saltatorisk ledning av aktionspotentialer genom att lokalisera spänningsstyrda Na+-kanaler till korta luckor mellan intilliggande skeden (kända som Ranvier-knutarna) och genom att fungera som elektriska isolatorer. Axoner som är helt myeliniserade i hela sin längd leder impulser många gånger snabbare än icke myeliniserade axoner med samma tvärsnittsstorlek (Waxman, 1980). Därför leder myeliniserade neurala kretsar information mycket snabbare än icke myeliniserade kretsar. Människor föds med ett praktiskt taget omyeliniserat CNS, och oligodendrocytpopulationen expanderar dramatiskt efter födseln med utbredd myelinisering under de första åren av barndomen. Myeliniseringen fortsätter under tonåren och in i vuxen ålder på ett karakteristiskt spatiotemporalt sätt, vilket korrelerar med uppkomsten och upprätthållandet av en korrekt kretsfunktion. Till exempel är mognaden av den vita substansen (de myelinrika områdena i CNS) samtidig med utvecklingen av kognitiva processer i barndomen, t.ex. informationsbehandlingshastighet (Mabbott et al., 2006; Scantlebury et al., 2014). Dessutom ses myelinpatologi/avvikelser inte bara i den demyeliniserande sjukdomen multipel skleros, utan även i flera neurodegenerativa sjukdomar (Kang et al., 2013; Huang et al., 2015) och neuroutvecklingsstörningar (Takahashi et al., 2011). Myelinisering av enskilda axoner är dock inte ett ”allt eller inget”-fenomen. Axonerna i CNS uppvisar en omfattande variation i antalet myelinskidor, skidlängd, skidtjocklek och fördelning längs deras längd. Det finns många olika mönster av myelinisering; till exempel har axoner med sparsamt myeliniserade områden beskrivits i juvenil och vuxen muscortex (Tomassy et al., 2014; Hill et al., 2018; Hughes et al., 2018). Modifiering av någon av dessa mantelparametrar har förutsägbara effekter på ledningshastigheten hos det underliggande axonet – därför kan det vara särskilt viktigt att etablera ett specifikt mönster av myelinisering längs ett axon för att finjustera kretsfunktionen. Till exempel uppvisar axoner i den auditiva hjärnstammen hos gerbils successivt kortare myelinskidor längs distala regioner för att säkerställa den exakta tidpunkten för signalens ankomst för att underlätta ljudlokalisering (Ford et al., 2015). Subtila förändringar i det övergripande myeliniseringsmönstret längs en axon (antingen genom att nytt myelin läggs till eller genom att befintligt myelin omformas) skulle kunna förändra tidpunkten för neurala impulser i kretsar på ett genomgripande sätt. Om myelin är anpassningsbart kan en ändring av sådana myeliniseringsmönster utgöra en kraftfull mekanism för att reglera kretsarnas funktion under hela livet.
Nyligen framkomna bevis tyder på att myelin kan vara anpassningsbart som svar på kretsaktivitet. Diffusionstensoravbildning av hela hjärnan kan användas för att mäta breda förändringar i den myelinrika vita substansen över tid – sådana experiment på människor och gnagare har visat att inlärning av en ny uppgift korrelerar med förändringar i den vita substansen i relevanta hjärnregioner (Scholz et al., 2009; Sampaio-Baptista et al., 2013). Analyser på cellnivå i djurmodeller visar att produktionen av nya myeliniserande oligodendrocyter krävs för effektiv motorisk inlärning (McKenzie et al., 2014; Xiao et al., 2016). Det finns för närvarande hypoteser om att aktivitet i neurala kretsar kan utlösa förändringar i myelin; en omfattande forskning har visat att neuronal aktivitet kan påverka proliferationen av oligodendrocytprekursorceller (OPC), differentieringen av oligodendrocyter samt bildandet och tillväxten av myelinskidor. Denna forskning, inklusive bevis för de inblandade molekylära signalerna, har granskats utförligt på andra håll (Fields, 2015; Almeida och Lyons, 2017; Mount och Monje, 2017). Neuronal aktivitet skulle kunna driva förändringar av myelin som i sin tur skulle kunna förändra ledningshastigheterna för att finjustera de tidpunkter som ligger till grund för kretsarnas funktion.
Däremot vet vi fortfarande inte om eller hur myeliniseringen av kretsar regleras dynamiskt under hela livet. Gammelforskningen visar att nya oligodendrocyter genereras i hela CNS även i vuxen ålder (Young et al., 2013), och OPC:er finns i den mänskliga vuxna hjärnan (Chang et al., 2000). Koldioxidanalyser av mänsklig vävnad har identifierat vuxenfödda oligodendrocyter i cortex, även om samma analyser visade att majoriteten av oligodendrocyterna i corpus callosum har sitt ursprung i tidig barndom (Yeung et al., 2014). De neuroimagingstudier på människor som korrelerar strukturella förändringar i den vita substansen med inlärning av uppgifter tyder dock på att nytt myelin kan bildas under hela livet. En sådan långvarig myelinisering skulle i princip kräva livslång produktion av oligodendrocyter, med tanke på att enskilda myeliniserande oligodendrocyter har ett begränsat tidsfönster på bara några timmar för att påbörja bildandet av nya mantlar (Watkins et al., 2008; Czopka et al., 2013) och att antalet mantlar per oligodendrocyt verkar vara stabilt över tid (Tripathi et al., 2017). En invändning som noteras av Mount och Monje (2017) är att ”födelsedatumet” i koldateringsexperimentet (som identifierar tidpunkten för DNA-replikation under celldelningen), återspeglar OPC:s datum, inte nödvändigtvis den differentierade oligodendrocyten. Detta är viktigt med tanke på bevis för att OPC:er direkt kan differentieras till oligodendrocyter utan celldelning, åtminstone hos gnagare (Hughes et al., 2013). OPC:er i corpus callosum kunde direkt differentiera till oligodendrocyter många år efter sin terminala celldelning; tidpunkten för differentiering av dessa nya oligodendrocyter kan således inte fastställas genom koldatering, och därför kan Yeung et al. (2014) ha underskattat hastigheten för produktion av oligodendrocyter i den vuxna mänskliga hjärnan. Vi har fortfarande mycket kvar att lära om de relativa bidragen från oligodendrocytbildning och myelinomvandling till CNS-utvecklingen under hela livet.
För att till fullo förstå den exakta dynamiken i oligodendrogenesen, myelinbildningen och myelinomvandlingen under olika stadier av livet utgör longitudinell avbildning med hög upplösning den gyllene metoden. Här ger vi en översikt över nyligen genomförda in vivo avbildningsstudier som börjar klargöra dynamiken i myeliniseringen, vilket också kommer att göra det möjligt för oss att börja förstå hur sådan dynamik kan påverka funktionen av neurala kretsar.
De novo Myelination
För att definitivt börja ta reda på hur oligodendrocyter genereras och hur myelin bildas och dynamiskt remodelleras in vivo, har man i två nyligen genomförda studier använt sig av upprepad tvåfotonavbildning av musens somatosensoriska hjärnbark under längre tidsperioder. Hughes et al. (2018) avbildade cortexen hos transgena reportermöss med fluorescerande märkta oligodendrogliala linjeceller från tidig vuxen ålder, genom medelålder och ålderdom (cirka P720). De fann att oligodendrocytpopulationen fortsätter att expandera och att den kortikala oligodendrocyttätheten nästan fördubblas mellan unga vuxna och medelålders stadier (figur 1A). Detta åtföljdes av en över dubbelt så stor ökning av antalet kortikala myelinskidor. Men hur ökar antalet oligodendrocyter? Under den tidiga postnatala utvecklingen produceras många oligodendrocyter, men endast en delmängd överlever och fortsätter att myelinisera axoner (Barres et al., 1992). Detta verkar vara likadant i vuxen ålder – genom att följa enskilda kortikala OPC:er i den vuxna cortexen i upp till 50 dagar visade Hughes et al. (2018) att majoriteten av de nyligen differentierade oligodendrocyterna genomgår celldöd, där endast 22 % överlever och förbinder sig till myelinisering (figur 1B). Det är fortfarande okänt hur stor andel av de nydifferentierade oligodendrocyterna som genereras efter OPC-delning jämfört med direkt differentiering. När oligodendrocyter väl har börjat myelinisera förblir de dock stabila, och det finns inga tecken på att myeliniserande oligodendrocyter genomgår celldöd under en 50-dagars avbildningsperiod.
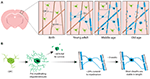
FIGUR 1. Oligodendrocyternas och myelinets dynamik i däggdjurens cortex under hela livet. (A) Oligodendrocytprekursorceller (OPC) genererar kontinuerligt nya myeliniserande oligodendrocyter (OL) i den somatosensoriska cortexen från födseln fram till medelåldern. OL-populationen minskar sedan i ålderdomen, vilket åtföljs av en minskning av myelintäckningen. (B) Linjespårning av enskilda OPC:er visar att även om förmyeliniserande OL:er kontinuerligt produceras i vuxen ålder är det bara cirka 20 % som överlever för att myeliniseras. De flesta myelinskidor är, när de väl har bildats, stabila i längd under en längre tidsperiod, vilket tyder på att det normalt sker en mycket liten omformning av befintligt myelin. Sammanfattning av data från Hill et al. (2018) och Hughes et al. (2018).
Samma sak gäller för Hill et al. (2018) som använde transgena rapportörer av oligodendrocyter och den märkningsfria spektrala konfokala reflektionstekniken (SCoRe) för mikroskopi för att avbilda myelin längs axoner (Schain et al., 2014) i den somatosensoriska hjärnbarken hos juvenila, unga vuxna, medelålders och gamla möss (P950). De fann också att antalet oligodendrocyter fortsätter att expandera i vuxen ålder upp till P650, och att oligodendrocyterna är stabila i medelåldern upp till 80 dagars avbildning. De fann att myeliniseringen av cortex också når sin topp i medelåldern vid P650 och att oligodendrocyttätheten sjunker betydligt från sin topp (vid P650) till mycket hög ålder (P950) (figur 1A). Detta återspeglades i en minskning av myelintäckningen av kortikala axoner i lager I mellan P650 och P950. Den långsiktiga oligodendrocytöverlevnaden kan variera mellan olika delar av CNS. Tripathi et al. (2017) märkte myeliniserande oligodendrocyter vid P60 hos möss och räknade sedan hur många märkta celler som överlevde fram till P605 i flera CNS-regioner. De fann att i ryggmärgen och den motoriska cortexen överlevde 60-70 % av de P60-märkta cellerna, medan i corpus callosum överlevde över 90 % av de P60-märkta cellerna. Minskningen av antalet oligodendrocyter och myeliniseringen i vissa CNS-regioner med åldern väcker spännande frågor om myelinförlustens roll i åldersassocierad kognitiv försämring. MRI-analyser visar att mikrostrukturen i den vita substansen korrelerar med flytande intelligens (Ritchie et al., 2015), men också att denna mikrostruktur i den vita substansen försämras med stigande ålder (Cox et al., 2016). Efterföljande åldersassocierad myelinförlust skulle kunna leda till minskad kognitiv funktion på grund av dysreglering av myeliniserade kretsar.
Kanske genereringen av nya oligodendrocyter (och därefter nytt myelin) i den vuxna hjärnbarken vara responsiv för kretsaktivitet? Tidigare forskning har visat att minskad sensorisk input genom att ta bort morrhår från möss leder till minskad oligodendrogenes i den somatosensoriska cortexen (Hill et al., 2014). För att undersöka detta ytterligare gav Hughes et al. (2018) vuxna (P365) möss sensorisk stimulering i tre veckor genom att hänga upp pärlor i djurburarna för att upprepade gånger stimulera deras morrhår och därmed den somatosensoriska cortexen. Genom att avbilda den somatosensoriska cortexen före och efter de 3 veckorna visade de att sensorisk stimulering ökar antalet oligodendrocyter, potentiellt på grund av ökad överlevnad av nyligen differentierade celler. Kougioumtzidou et al. (2017) gav ytterligare bevis för att kretsaktivitet kan vara viktig för att reglera cellöverlevnad – de visade att förlust av AMPA-receptorunderenheterna 2, 3 och 4 i OPC leder till minskad överlevnad av oligodendrocyter. Detta tyder på att de novo myelinisering skulle kunna moduleras av den kortikala kretsaktiviteten under hela livet, kanske för att finjustera funktionen hos samma kretsar.
Många frågor återstår att lösa: vilken effekt har oligodendrogenesen och den nya myeliniseringen på den faktiska kretsfunktionen? Förbättrar neuronal aktivitet den långsiktiga överlevnaden av myeliniserande oligodendrocyter? Det är möjligt att förlusten av oligodendrocyter vid hög ålder beror på en åldersassocierad minskning av den neuronala aktiviteten, vilket i sin tur kan påverka den totala oligodendrocytöverlevnaden. Alternativt kan det vara så att oligodendrocyter har en begränsad livslängd oberoende av neuronal aktivitet (antingen intrinsiskt programmerad eller påverkad av andra extrinsiska signaler som är förknippade med åldrande). I båda fallen skulle stimulering av kretsar kunna bidra till att lindra åldersassocierad myelinförlust genom att antingen främja överlevnaden av befintliga oligodendrocyter eller stimulera produktionen av nya oligodendrocyter. Detta skulle i sin tur kunna få betydande konsekvenser för behandling och förebyggande av åldersassocierad kognitiv försämring.
Aktivitetsmedierad oligodendrogenes är inte begränsad till den somatosensoriska cortexen – unga vuxna möss som genomgår motorisk inlärning visar också en ökning av antalet nydifferentierade oligodendrocyter i den motoriska cortexen (Xiao et al., 2016). Hur är det med andra områden i CNS? Många kortikala axoner projicerar via corpus callosum, och därför kan stimulering av kortikala kretsar signalera till både kortikala och callosala OPC:er. Två gnagarstudier har visat att stimulering av kortikala neuroner inducerar oligodendrogenes i corpus callosum. Gibson et al. (2014) stimulerade optogenetiskt projektionsneuroner i lager V i den premotoriska cortexen och fann en ökning av OPC-proliferationen i både den premotoriska cortexen och corpus callosum. Detta ledde till en ökning av antalet oligodendrocyter och manteltjocklek fyra veckor efter stimuleringen. Mer nyligen använde Mitew et al. (2018) Designer Receptors Exclusively Activated by Designer Drugs för att stimulera somatosensoriska neuroner i lager 2/3 och observerade också ökad OPC-proliferation, oligodendrogenes och tjockare myelinskidor i corpus callosum hos både unga och vuxna möss. De visade också att nya oligodendrocyter företrädesvis bildar myelinskidor på de aktiva axonerna. Detta tyder på att aktivitetsinducerad de novo myelinisering i princip kan inriktas på aktiva axoner/kretsar. Det är fortfarande okänt hur långvariga förändringar av myelin som svar på neuronal aktivitet kan vara. Den långsiktiga överlevnad av myeliniserande celler som Tripathi et al. (2017), Hill et al. (2018) och Hughes et al. (2018) noterat tyder på att när en oligodendrocyt väl bildar myelinskidor är det troligt att den kommer att överleva även om neuronala aktivitetsnivåer återgår tillbaka till baslinjen. Huruvida myelinskedena i sig förändras när den neuronala aktiviteten återgår till normala nivåer kräver mer undersökningar av individuella skiddynamiker, vilket diskuteras nedan.
Det är alltså möjligt att livslång de novo myelinisering kan förekomma i många CNS-regioner, där axoner som lämpar sig för myelinisering har tillräckligt med omyeliniserat utrymme. Det är dock fortfarande oklart i vilken utsträckning oligodendrogenesen fortsätter i olika områden i den vuxna mänskliga hjärnan. Analyser av koldioxider tyder på att de flesta oligodendrocyter i corpus callosum-trakten genereras i tidig barndom (Yeung et al., 2014). Immunohistokemisk analys av mänsklig hjärnvävnad med hjälp av en ny markör för nydifferentierade oligodendrocyter (BCAS1) visar nya oligodendrocyter i den frontala cortexen även bortom medelåldern, men mycket få nya oligodendrocyter i den vita substansen efter det tredje levnadsdecenniet (Fard et al., 2017). Denna skillnad i oligodendrogenes mellan arter kan vara ett resultat av skalan. Hughes et al.’s (2013) data från gnagare tyder på att oligodendrocyter genereras i stort överskott, med kontinuerlig beskärning av nästan 80 % av cellerna. Med tanke på energikostnaden för en sådan process, är denna mekanism hållbar under hela livet i ett organ av den mänskliga hjärnans storlek? Kanske finns det i den mänskliga hjärnan en begränsad överproduktion av oligodendrocyter på grund av ett behov av mer långvarig myelinisering av det större CNS, eller på grund av att signaler som neuronal aktivitet stimulerar OPC:er att differentiera till oligodendrocyter efter behov.
Myelinomvandling
Omvandlingen av befintliga myelinskidor skulle kunna förändra ledningsegenskaperna utan att det krävs att man genererar nya oligodendrocyter eller myelin. Genom att ändra längden på befintliga myelinskidor skulle myelinets täckning längs en axon och avståndet mellan Ranvier-knutarna kunna förändras (vilket båda skulle påverka ledningshastigheterna). Dessutom kan även mycket subtila ombildningar av myelin förändra längden på själva noderna. Det har nyligen visats att nodlängden kan variera kraftigt i synnerven och i cortex, och att en förändring av nodlängderna längs en axon i princip också kan förändra ledningshastigheten avsevärt (Arancibia-Cárcamo et al., 2017). Huruvida förändringar av node of Ranvier främst drivs av myelinisering eller omorganisering av själva axonet återstår att fastställa.
Både Hill et al. (2018) och Hughes et al. (2018) utförde longitudinella studier av enskilda myelinskidor i den somatosensoriska hjärnbarken hos musen under flera veckor för att bedöma om skidlängderna är dynamiskt reglerade. Hill et al. (2018) fann att i tidig vuxen ålder (P90-120), även om vissa mantlar uppvisar förlängning eller krympning, var 81 % av de observerade mantlarna stabila. Fler mantlar kan bli stabila i längd med åldern; Hughes et al. (2018) följde mantlar hos äldre (P365) djur och såg att 99 % av mantlarna förblev stabila under tre veckor (figur 1B).
Samma mantellängdsstabilitet har också beskrivits på andra ställen; Auer et al. (2018) använde larviga zebrafiskar för att undersöka om enskilda mantlar kan förändras i längd med tiden genom att utföra tidsförloppslive-avbildning av fluorescerande märkta myelinmantlar. De fann att individuella skidor genomgår en snabb men varierande tillväxt under de första dagarna efter bildandet, innan de stabiliserar sina skidlängder. När de väl är stabiliserade fortsätter mantlarna bara att växa för att anpassa sig till djurets totala tillväxt.
Varför förändras vissa mantlar i cortex i längd, medan andra inte gör det? Detta kan avspegla skillnader i kraven från olika neurala kretsar. Axonal mångfald har observerats under den initiala myeliniseringen i zebrafiskens ryggmärg, där vissa axoner använder synaptisk vesikelfrisättning för att reglera myelinskidans antal och längd medan andra inte gör det (Koudelka et al., 2016). Detta väcker den spännande hypotesen att endast vissa axoner kan reglera myelin via aktivitetsrelaterade signaler. Hughes et al. (2018) fann att deras paradigm för sensorisk stimulering inte ökade andelen dynamiska skidor i den somatosensoriska cortexen. En mer detaljerad analys av mångfald av axonsubtyper i kombination med longitudinella studier av dynamiken i mantellängden skulle dock kunna bekräfta om mantellängdens ommodellering är specifik för vissa kretsar.
Speglar stabiliteten i mantellängden en oförmåga för mantlar att ommodellera? Experiment i zebrafiskar tyder på att ommodellering av mantellängden kan framkallas när myeliniseringsprofilen för ett axon störs. Auer et al. (2018) avlägsnade enskilda oligodendrocyter och tog därför sparsamt bort mantlar längs axonerna. De fann att när en enskild myelinskida förloras på ett fullt myeliniserat axon kan de angränsande skidorna åter initiera snabb tillväxt för att täcka den icke myeliniserade luckan. I flera fall bildades en ny myelinskida i stället för sin föregångare och kunde till och med trycka tillbaka mot de invaderande grannskidorna för att återställa det ursprungliga myeliniseringsmönstret (figur 2A). Ibland bibehålls därför ett specifikt myeliniseringsmönster företrädesvis, även efter att myelinet har brutits upp. Detta kan vara för att upprätthålla de optimerade ledningsegenskaperna hos det underliggande axonet. Auer et al. (2018) observerade sparsamt myeliniserade axoner i larviga zebrafiskar, vilket tidigare identifierats i gnagarnas cortex. Intressant nog fann de att vid ablation av enskilda mantlar på sådana sparsamt myeliniserade axoner bildades en ny mantel på praktiskt taget samma plats som den ablade manteln, även längs en i övrigt icke myeliniserad sträcka av axonet (figur 2B). Således verkar myeliniseringsmönstren längs sparsamt myeliniserade axoner också vara stabilt bibehållna i zebrafiskar, vilket Hill et al. (2018) föreslår hos gnagare. Funktionen av glesa myeliniseringsprofiler är fortfarande okänd. Sådana mönster kan möjliggöra en mer dynamisk finjustering av enskilda axoners funktion över tid, även om det också är möjligt att sådana icke myeliniserade luckor kan underlätta gradvis myelinisering för att upprätthålla konsekventa ledningstider inom kretsar, när djuret växer och/eller axonlängderna förändras.
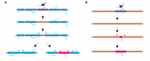
FIGUR 2. Myelinomvandling kan ske in vivo. (A) Ablation av enskilda mantlar på en fullt myeliniserad axon kan framkalla snabb tillväxt av angränsande mantlar för att täcka luckan. Luckan kan antingen täckas helt och hållet av de angränsande mantlarna, eller så kan den ursprungliga myeliniseringsprofilen återställas genom att en ny mantel läggs till. (B) Ablation av en mantel på ett sparsamt myeliniserat axon följs av bildandet av en ny myelinmantel med identisk storlek och placering som den ablade föregångarmanteln. Sammanfattning av data från Auer et al. (2018).
Har stabila myelinskidor hos däggdjur också denna förmåga att remodelleras när myeliniseringsmönstret störs? Ytterligare longitudinella studier kopplade till demyelinisering krävs för att besvara denna fråga. Det är möjligt att sådan remodellering inte induceras av neuronal aktivitet utan är en kompensationsmekanism för myelinförlust. Åldersassocierad förlust av oligodendrocyter skulle kunna utlösa ommodellering av de överlevande mantlarna för att täcka de avstängda delarna av axonet och därmed bidra till att upprätthålla kretsens funktion. Livebild av myelinskidor vid hög ålder skulle kunna avgöra om så är fallet.
De studier med livebild som diskuteras här har alla bedömt myelinskidans längddynamik, men inte myelinskidans tjocklek. Kan skidtjockleken regleras dynamiskt? Stimulering av PI3K/AKT/mTOR-signalering i oligodendrocyter hos vuxna möss utlöser ytterligare myelinomslag för att öka manteltjockleken (Snaidero et al., 2014). Detta kan moduleras av kretsaktivitet, eftersom neuronal stimulering leder till ökad manteltjocklek hos både juvenila och vuxna möss (Gibson et al., 2014; Mitew et al., 2018). Detta understryker behovet av att avbilda alla mantelparametrar longitudinellt för att fullt ut förstå dynamiken i mantelombildningen. Det finns ett behov av live-bildmodaliteter för att exakt mäta manteltjocklek längs axoner, eftersom detta för närvarande kräver tvärsnittsmätning via elektronmikroskopi, vilket begränsar analysen till en enda tidpunkt. Vissa märkningsfria avbildningstekniker, såsom tredje harmonisk generationsmikroskopi och spektralreflektometri, är lovande för att utföra sådana mätningar (Lim et al., 2014; Kwon et al., 2017). Genom att koppla dessa tekniker till longitudinella studier av gnagarnas cortex skulle man kunna avgöra om etablerade myelinskidor kan justera sin tjocklek, eller om neuronal aktivitet helt enkelt driver på de novo myeliniseringen för att producera tjockare skidor.
Det verkar därför som att även om myelinskidor har möjlighet att remodelleras när myelinet bryts, så är de flesta skidor generellt sett stabila i längd. Denna stabilitet kan bero på upprätthållandet av tidigt etablerade myeliniseringsmönster som är optimerade för kretsfunktion.
Framtiden
Nyligen genomförda avbildningsstudier på däggdjur har fokuserat på de novo-myelinisering och remodellering av mantlar i kortikal grå substans. Kortikala kretsar tar emot och sänder information via många regioner, t.ex. ryggmärgen och corpus callosum, och därför kan förändringar av myelin i flera olika områden i CNS förändra signaleringen i en enda krets. CNS beskrivs traditionellt efter utseende efter formaldehydfixering, där ”vit substans” beskriver de starkt myeliniserade axonbanorna, medan ”grå substans” beskriver regioner som är tätt packade med neuronala cellkroppar, dendriter och synapser. Denna klassificering är dock alltför förenklad; OPC producerar myeliniserande oligodendrocyter i både grå och vit substans (Dawson et al., 2003), och i själva verket finns det nya bevis för mångfald i oligodendrogliallinjen och i myeliniseringsmönster i både grå och vit substans (Rivers et al., 2008; Viganò et al., 2013; Young et al., 2013; Bechler et al., 2015). En sådan mångfald kan återspegla de unika kraven på myelin i skilda områden, och potentiellt på skilda kretsar, i CNS. Ytterligare longitudinella avbildningsstudier krävs för att bättre förstå dynamiken i de novo myelinisering och remodellering av skidan i områden av CNS utanför cortex.
Men medan den optiska transparensen hos den larviga zebrafisken lämpar sig för icke-invasiv levande avbildning är det mer invasivt och tekniskt utmanande att utföra sådana experiment i däggdjurs CNS. Hill et al. (2018) och Hughes et al. (2018) använde sig av två-fotonmikroskopi med kraniala avbildningsfönster för att avbilda djup upp till 400 μm in i cortex. Liknande tekniker skulle kunna användas för att avbilda ytliga myeliniserade banor i ryggmärgen över tid (Locatelli et al., 2018), men djupare CNS-regioner kan inte penetreras med enbart tvåfotonmikroskopi. Ett alternativ är att använda tvåfotonmikroendoskopi, där en mikroendoskopisk sond med en lins med gradientbrytningsindex (GRIN) förs in i vävnaden för att avbilda celler djupare i hjärnan . Införandet av endoskopet kan dock leda till inflammatoriska reaktioner som kan påverka myeliniseringen. Ett alternativ skulle kunna vara tre-fotonmikroskopi med hjälp av kranial imaging window-metoden, som också tidigare har använts för att avbilda hippocampus (Horton et al., 2013; Ouzounov et al., 2017). Tre-fotonmikroskopi ger ett betydligt större förhållande mellan signal och bakgrund än två-fotonmikroskopi och kan därför användas för att avbilda djupare vävnadsstrukturer.
Det är särskilt viktigt att ta hänsyn till inte bara olika CNS-regioner, utan även olika neuroner inom dessa regioner. Tidigare forskning tyder på att det finns mekanistiska skillnader i hur olika neuronsubtyper reglerar sin myelinisering (Koudelka et al., 2016). Dessutom kan det finnas mångfald i den lokala regleringen av myelin. Det är viktigt att komma ihåg att olika delar av CNS inte är separata enheter utan är sammankopplade. Att integrera mesoskalig connectomik, som fokuserar på att förstå kopplingarna mellan olika neuronsubtyper i olika regioner (Zeng, 2018), kommer att vara avgörande för vår förståelse av hur den livslånga myeliniseringsdynamiken varierar mellan olika kretsar.
Vad är den funktionella konsekvensen av myelinregleringen längs olika kretsar? Hittills kan de funktionella konsekvenserna endast härledas genom korrelationer med beteende. I slutändan finns det ett behov av att koppla ihop mätning av myelinets dynamik med direkt bedömning av kretsaktivitet. Detta kommer att kräva registrering av neuronal aktivitet under longitudinella studier av myelinisering för att direkt koppla de novo myelinisering eller ombyggnad av skidan som observerats till förändringar i kretsarnas funktion med tiden. Det kommer att vara viktigt att mäta myelindynamiken och den elektrofysiologiska aktiviteten hos enskilda neuroner och axoner för att fastställa hur förändringar i de olika parametrarna för myelinskidan faktiskt påverkar ledningsegenskaperna på cellnivå, samt att bedöma aktiviteten på populationsnivå. Verktyg som genetiskt kodade Ca2+- eller spänningsindikatorer möjliggör relativt icke-invasiv registrering av kretsaktivitet och kan till och med användas för att bedöma kretsaktivitet i hela hjärnan (Ahrens et al., 2012; Lovett-Barron et al., 2017).
Slutsats
Myeliniseringen av axoner utgör en kraftfull potentiell mekanism för att reglera kretsfunktionen under hela livet. Forskning har visat att de novo myelinisering i cortex (via produktion av nya oligodendrocyter) sker även i vuxen ålder, och att detta kan förstärkas genom att stimulera kretsaktivitet. När myelin väl har bildats är det stabilt med liten omsättning av oligodendrocyter och begränsad omformning av längden på befintliga myelinskidor. Dessa stabila strukturer kan dock behålla förmågan att omformas om myelinet störs. Detta har intressanta implikationer för myelinets plasticitet när det gäller att upprätthålla kretsfunktionen vid skada, sjukdom och ålderdom. Exakt hur förändringar i myeliniseringen påverkar funktionen hos den underliggande kretsen återstår att se. I slutändan krävs ett tillvägagångssätt på kretsnivå, som integrerar analys av myelinets dynamik med direkt mätning av kretsens funktion, för att fullt ut uppskatta hur dynamisk myelinisering påverkar nervsystemets övergripande funktion under hela livet.
Författarbidrag
Alla författare som anges har lämnat ett väsentligt, direkt och intellektuellt bidrag till arbetet och godkänt det för publicering.
Finansiering
DAL stöds av ett Wellcome Trust Senior Research Fellowship (102836/Z/13/Z). JMW stöds av ett stipendium för doktorsexamen i vävnadsreparation vid University of Edinburgh (MRC Doctoral Training Partnership MR/K501293/1) och Wellcome Trusts fyraåriga doktorandprogram i vävnadsreparation (Grant 108906/Z/15/Z).
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Ahrens, M. B., Li, J. M., Orger, M. B., Robson, D. N., Schier, A. F., Engert, F., et al. (2012). Neuronal dynamik i hela hjärnan under motorisk anpassning hos zebrafiskar. Nature 485, 471-477. doi: 10.1038/nature11057
PubMed Abstract | CrossRef Full Text | Google Scholar
Almeida, R. G., and Lyons, D. A. (2017). Om myeliniserad axonplasticitet och neuronal kretsbildning och funktion. J. Neurosci. 37, 10023-10034. doi: 10.1523/JNEUROSCI.3185-16.2017
CrossRef Full Text | Google Scholar
Arancibia-Cárcamo, I. L., Ford, M. C., Cossell, L., Ishida, K., Tohyama, K. och Attwell, D. (2017). Node of Ranvier length as a potential regulator of myelinated axon conduction speed. eLife 6:e23329. doi: 10.7554/eLife.23329
PubMed Abstract | CrossRef Full Text | Google Scholar
Auer, F., Vagionitis, S. och Czopka, T. (2018). Bevis för ommodellering av myelinskidan i CNS avslöjad med hjälp av in vivo-avbildning. Curr. Biol. 28, 549-559. doi: 10.1016/j.cub.2018.01.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Barres, B. A., Hart, I. K., Coles, H. S. R., Burne, J. F., Voyvodic, J. T., Richardson, W. D., et al. (1992). Celldöd och kontroll av cellöverlevnad i oligodendrocytlinjen. Cell 70, 31-46. doi: 10.1016/0092-8674(92)90531-G
CrossRef Full Text | Google Scholar
Bechler, M. E., Byrne, L., and Ffrench-Constant, C. (2015). CNS myelinskidans längd är en inneboende egenskap hos oligodendrocyter. Curr. Biol. 25, 2411-2416. doi: 10.1016/j.cub.2015.07.056
PubMed Abstract | CrossRef Full Text | Google Scholar
Chang, A., Nishiyama, A., Peterson, J., Prineas, J. och Trapp, B. D. (2000). NG2-positiva oligodendrocytprogenitorceller i vuxen mänsklig hjärna och multipel sklerosläsioner. J. Neurosci. 20, 6404-6412. doi: 10.1523/JNEUROSCI.20-17-06404.2000
PubMed Abstract | CrossRef Full Text | Google Scholar
Cox, S. R., Ritchie, S. J., Tucker-Drob, E. M., Liewald, D. C., Hagenaars, S. P., Davies, G., et al. (2016). Ageing and brain white matter structure in 3,513 UK Biobank participants. Nat. Commun. 7:13629. doi: 10.1038/ncomms13629
PubMed Abstract | CrossRef Full Text | Google Scholar
Czopka, T., Ffrench-Constant, C. och Lyons, D. A. (2013). Enskilda oligodendrocyter har bara några timmar på sig att generera nya myelinskidor in vivo. Dev. Cell 25, 599-609. doi: 10.1016/j.devcel.2013.05.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Dawson, M. R. L., Polito, A., Levine, J. M. och Reynolds, R. (2003). NG2-uttryckande glial progenitorceller: en riklig och utbredd population av cyklande celler i den vuxna råttans CNS. Mol. Cell. Neurosci. 24, 476-488. doi: 10.1016/S1044-7431(03)00210-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Fard, M. K., Van der Meer, F., Sánchez, P., Cantuti-Castelvetri, L., Mandad, S., Jäkel, S., et al. (2017). BCAS1-uttryck definierar en population av tidiga myeliniserande oligodendrocyter i multipel skleroslesioner. Sci. Transl. Med. 9:eaam7816. doi: 10.1126/scitranslmed.aam7816
PubMed Abstract | CrossRef Full Text | Google Scholar
Fields, R. D. (2015). En ny mekanism för nervsystemets plasticitet: aktivitetsberoende myelinisering. Nat. Rev. Neurosci. 16, 756-767. doi: 10.1038/nrn4023
PubMed Abstract | CrossRef Full Text | Google Scholar
Ford, M. C., Alexandrova, O., Cossell, L., Stange-Marten, A., Sinclair, J., Kopp-Scheinpflug, C., et al. (2015). Justering av Ranvierknutens och internodens egenskaper i myelinerade axoner för att justera aktionspotentialens timing. Nat. Commun. 6:8073. doi: 10.1038/ncomms9073
PubMed Abstract | CrossRef Full Text | Google Scholar
Gibson, E. M., Purger, D., Mount, C. W., Goldstein, A. K., Lin, G. L., Wood, L. S., et al. (2014). Neuronal aktivitet främjar oligodendrogenesis och adaptiv myelinisering i däggdjurshjärnan. Science 344:1252304. doi: 10.1126/science.1252304
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Li, A. M., and Grutzendler, J. (2018). Livslång kortikal myelinplastbarhet och åldersrelaterad degeneration i den levande däggdjurshjärnan. Nat. Neurosci. 21, 683-695. doi: 10.1038/s41593-018-0120-6
PubMed Abstract | CrossRef Full Text | Google Scholar
Hill, R. A., Patel, K. D., Goncalves, C. M., Grutzendler, J. och Nishiyama, A. (2014). Modulation av oligodendrocytgenerering under ett kritiskt tidsfönster efter NG2-celldelning. Nat. Neurosci. 17, 1518-1527. doi: 10.1038/nn.3815
PubMed Abstract | CrossRef Full Text | Google Scholar
Horton, N. G., Wang, K., Kobat, D., Clark, C. G., Wise, F. W. W., Schaffer, C. B., et al. (2013). In vivo tre-fotonmikroskopi av subkortikala strukturer i en intakt mushjärna. Nat. Photonics 7, 205-209. doi: 10.1038/NPHOTON.2012.336
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, B., Wei, W., Wang, G., Gaertig, M. A., Feng, Y., Wang, W., et al. (2015). Mutant huntingtin nedreglerar myelinreglerande faktor-medierat myelin-genuttryck och påverkar mogna oligodendrocyter. Neuron 85, 1212-1226. doi: 10.1016/j.neuron.2015.02.026
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Kang, S. H., Fukaya, M. och Bergles, D. E. (2013). Oligodendrocytprogenitorerna balanserar tillväxt med självreflektion för att uppnå homeostas i den vuxna hjärnan. Nat. Neurosci. 16, 668-676. doi: 10.1038/nn.3390
PubMed Abstract | CrossRef Full Text | Google Scholar
Hughes, E. G., Orthmann-Murphy, J. L., Langseth, A. J. och Bergles, D. E. (2018). Myelinremodellering genom erfarenhetsberoende oligodendrogenesis i den vuxna somatosensoriska cortexen. Nat. Neurosci. 21, 696-706. doi: 10.1038/s41593-018-0121-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Jung, J. C., Mehta, A. D., Aksay, E., Stepnoski, R. och Schnitzer, M. J. (2004). In vivo avbildning av däggdjurshjärnan med hjälp av en- och två-foton fluorescensmikroendoskopi. J. Neurophysiol. 92, 3121-3133. doi: 10.1152/jn.00234.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Kang, S. H., Li, Y., Fukaya, M., Lorenzini, I., Cleveland, D. W., Ostrow, L. W., et al. (2013). Degeneration och försämrad regeneration av oligodendrocyter i grå substans vid amyotrofisk lateralskleros. Nat. Neurosci. 16, 571-579. doi: 10.1038/nn.3357
PubMed Abstract | CrossRef Full Text | Google Scholar
Koudelka, S., Voas, M. G., Almeida, R. G., Baraban, M., Soetaert, J., Meyer, M. P., et al. (2016). Individuella neuronala subtyper uppvisar mångfald i CNS myelinisering medierad av synaptisk vesikelfrisättning. Curr. Biol. 26, 1447-1455. doi: 10.1016/j.cub.2016.03.070
PubMed Abstract | CrossRef Full Text | Google Scholar
Kougioumtzidou, E., Shimizu, T., Hamilton, N. B., Tohyama, K., Sprengel, R., Monyer, H., et al. (2017). Signalering genom AMPA-receptorer på oligodendrocytprekursorer främjar myelinisering genom att öka oligodendrocytöverlevnaden. eLife 6:e2808080. doi: 10.7554/eLife.28080
PubMed Abstract | CrossRef Full Text | Google Scholar
Kwon, J., Kim, M., Park, H., Kang, B.-M., Jo, Y., Kim, J.-H., et al. (2017). Etikettfri nanoskala optisk metrologi på myeliniserade axoner in vivo. Nat. Commun. 8:1832. doi: 10.1038/s41467-017-01979-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Levene, M. J., Dombeck, D. A., Kasischke, K. A., Molloy, R. P. och Webb, W. W. (2004). Multiphotonmikroskopi in vivo av djup hjärnvävnad. J. Neurophysiol. 91, 1908-1912. doi: 10.1152/jn.01007.2003
PubMed Abstract | CrossRef Full Text | Google Scholar
Lim, H., Sharoukhov, D., Kassim, I., Zhang, Y., Salzer, J. L. och Melendez-Vasquez, C. V. (2014). Etikettfri avbildning av Schwanncells myelinisering med hjälp av tredje harmonisk generationsmikroskopi. Proc. Natl. Acad. Sci. U.S.A. 111, 18025-18030. doi: 10.1073/pnas.1417820111
PubMed Abstract | CrossRef Full Text | Google Scholar
Locatelli, G., Theodorou, D., Kendirli, A., Jordão, M. J. C., Staszewski, O., Phulphagar, K., et al. (2018). Mononukleära fagocyter specificerar och anpassar lokalt sin fenotyp i en modell för multipel skleros. Nat. Neurosci. 21, 1196-1208. doi: 10.1038/s41593-018-0212-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lovett-Barron, M., Andalman, A. S., Allen, W. E., Vesuna, S., Kauvar, I., Burns, V. M., et al. (2017). Uråldriga kretsar för samordnad modulering av hjärnans tillstånd. Cell 171, 1411-1423. doi: 10.1016/j.cell.2017.10.021
PubMed Abstract | CrossRef Full Text | Google Scholar
Mabbott, D. J., Noseworthy, M., Bouffet, E., Laughlin, S. och Rockel, C. (2006). Tillväxt av vit substans som en mekanism för kognitiv utveckling hos barn. Neuroimage 33, 936-946. doi: 10.1016/j.neuroimage.2006.07.024
PubMed Abstract | CrossRef Full Text | Google Scholar
McKenzie, I. A., Ohayon, D., Li, H., Paes de Faria, J., Emery, B., Tohyama, K., et al. (2014). Inlärning av motoriska färdigheter kräver aktiv central myelinisering. Science 346, 318-322. doi: 10.1126/science.1254960
PubMed Abstract | CrossRef Full Text | Google Scholar
Mitew, S., Gobius, I., Fenlon, L. R., McDougall, S. J., Hawkes, D., Xing, Y. L., et al. (2018). Farmakogenetisk stimulering av neuronal aktivitet ökar myeliniseringen på ett axonspecifikt sätt. Nat. Commun. 9:306. doi: 10.1038/s41467-017-02719-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mount, C. W., and Monje, M. (2017). Inslag för att anpassa sig: erfarenhetsberoende myelinisering. Neuron 95, 743-756. doi: 10.1016/j.neuron.2017.07.009
PubMed Abstract | CrossRef Full Text | Google Scholar
Ouzounov, D. G., Wang, T., Wang, M., Feng, D. D., Horton, N. G., Cruz-Hernández, J. C., et al. (2017). In vivo trefotonavbildning av aktiviteten hos GCaMP6-märkta neuroner djupt i intakt mushjärna. Nat. Methods 14, 388-390. doi: 10.1038/nmeth.4183
PubMed Abstract | CrossRef Full Text | Google Scholar
Ritchie, S. J., Bastin, M. E., Tucker-Drob, E. M., Maniega, S. M., Engelhardt, L. E., Cox, S. R., et al. (2015). Kopplade förändringar i hjärnans vita substansmikrostruktur och flytande intelligens senare i livet. J. Neurosci. 35, 8672-8682. doi: 10.1523/JNEUROSCI.0862-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Rivers, L. E., Young, K. M., Rizzi, M., Jamen, F., Psachoulia, K., Wade, A., et al. (2008). PDGFRA/NG2-glia genererar myeliniserande oligodendrocyter och piriforma projektionsneuroner hos vuxna möss. Nat. Neurosci. 11, 1392-1401. doi: 10.1038/nn.2220
PubMed Abstract | CrossRef Full Text | Google Scholar
Sampaio-Baptista, C., Khrapitchev, A. A., Foxley, S., Schlagheck, T., Scholz, J., Jbabdi, S., et al. (2013). Inlärning av motoriska färdigheter inducerar förändringar i den vita substansens mikrostruktur och myelinisering. J. Neurosci. 33, 19499-19503. doi: 10.1523/jneurosci.3048-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Scantlebury, N., Cunningham, T., Dockstader, C., Laughlin, S., Gaetz, W., Rockel, C., et al. (2014). Samband mellan mognad av vit substans och reaktionstid i barndomen. J. Int. Neurophsychol. Soc. 20, 99-112. doi: 10.1017/S1355617713001148
PubMed Abstract | CrossRef Full Text | Google Scholar
Schain, A. J., Hill, R. A., and Grutzendler, J. (2014). Etikettfri in vivo avbildning av myeliniserade axoner i hälsa och sjukdom med spektral konfokal reflektionsmikroskopi. Nat. Med. 20, 443-449. doi: 10.1038/nm.3495
PubMed Abstract | CrossRef Full Text | Google Scholar
Scholz, J., Klein, M. C., Behrens, T. E. J., and Johansen-berg, H. (2009). Träning inducerar förändringar i den vita massans arkitektur. Nat. Neurosci. 12, 1370-1371. doi: 10.1038/nn.2412
PubMed Abstract | CrossRef Full Text | Google Scholar
Snaidero, N., Möbius, W., Czopka, T., Hekking, L. H. P., Mathisen, C., Verkleij, D., et al. (2014). Myelinmembraninpackning av CNS axoner genom PI(3,4,5)P3-beroende polariserad tillväxt vid den inre tungan. Cell 156, 277-290. doi: 10.1016/j.cell.2013.11.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Takahashi, N., Sakurai, T., Davis, K. L. och Buxbaum, J. D. (2011). Koppling av oligodendrocyt- och myelin-dysfunktion till neurokretsavvikelser vid schizofreni. Prog. Neurobiol. 93, 13-24. doi: 10.1016/j.pneurobio.2010.09.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Tomassy, G. S., Berger, D. R., Chen, H.-H., Kasthuri, N., Hayworth, K. J., Vercelli, A., et al. (2014). Distinkta profiler av myelinfördelning längs enskilda axoner av pyramidala neuroner i neocortex. Science 344, 319-324. doi: 10.1126/science.1249766
PubMed Abstract | CrossRef Full Text | Google Scholar
Tripathi, R. B., Jackiewicz, M., Mckenzie, I. A., Kougioumtzidou, E., Grist, M. och Richardson, W. D. (2017). Anmärkningsvärd stabilitet hos myeliniserande oligodendrocyter hos möss. Cell Rep. 21, 316-323. doi: 10.1016/j.celrep.2017.09.050
PubMed Abstract | CrossRef Full Text | Google Scholar
Viganò, F., Möbius, W., Götz, M. och Dimou, L. (2013). Transplantation avslöjar regionala skillnader i oligodendrocytdifferentiering i den vuxna hjärnan. Nat. Neurosci. 16, 1370-1372. doi: 10.1038/nn.3503
PubMed Abstract | CrossRef Full Text | Google Scholar
Watkins, T. A., Emery, B., Mulinyawe, S. och Barres, B. A. (2008). Distinkta stadier av myelinisering som regleras av gamma-sekretas och astrocyter i ett snabbt myeliniserande CNS-kokultursystem. Neuron 60, 555-569. doi: 10.1016/j.neuron.2008.09.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Waxman, S. G. (1980). Bestämmande faktorer för ledningshastighet i myeliniserade nervfibrer. Muscle Nerve 3, 141-150. doi: 10.1002/mus.880030207
PubMed Abstract | CrossRef Full Text | Google Scholar
Xiao, L., Ohayon, D., Mckenzie, I. A., Sinclair-Wilson, A., Wright, J. L., Fudge, A. D., et al. (2016). Snabb produktion av nya oligodendrocyter krävs i de tidigaste stadierna av inlärning av motoriska färdigheter. Nat. Neurosci. 19, 1210-1217. doi: 10.1038/nn.4351
PubMed Abstract | CrossRef Full Text | Google Scholar
Yeung, M. S. Y., Zdunek, S., Bergmann, O., Bernard, S., Salehpour, M., Alkass, K., et al. (2014). Dynamiken i oligodendrocytgenerering och myelinisering i den mänskliga hjärnan. Cell 159, 766-774. doi: 10.1016/j.cell.2014.10.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Young, K. M., Psachoulia, K., Tripathi, R. B., Dunn, S.-J., Cossell, L., Attwell, D., et al. (2013). Oligodendrocytdynamik i det friska vuxna CNS: bevis för myelinremodellering. Neuron 77, 873-885. doi: 10.1016/j.neuron.2013.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, H. (2018). Mesoskalig connectomik. Curr. Opin. Neurobiol. 50, 154-162. doi: 10.1016/j.conb.2018.03.003
PubMed Abstract | CrossRef Full Text | Google Scholar
.