Aspartataminotransferasav Luke Spooner
Innehåll
- 1 Funktion
- 2 Struktur
- 3 Funktion
- 4 Kliniska tillämpningar
- 5 3D-strukturer för aspartataminotransferas
Funktion
Aspartataminotransferas (AAT), även känt som glutamisk aspartat transaminas, glutamisk oxaloacetat transaminas, prefenataminotransferas och transaminas A är ett enzym som är en medlem av klass-I pyridoxalfosfatberoende aminotransferasfamiljen . Det kodas av genen GOT1. Det är en homodimer som är 413 aminosyror lång och har en kritisk roll i aminosyra- och kolhydratmetabolismen, ureogenesen och överföringen av reducerande ekvivalenter till mitokondrier och kloroplaster. I prokaryota celler finns den uteslutande i cytosolen, men i eukaryota celler finns det isozymer i cytosol, mitokondrier och kloroplast. Bifunktionellt aspartataminotransferas (BAAT) krävs för transaminering av prefanat till arogenat.
I människokroppen produceras det i hjärnan, skelettmusklerna, levern, bukspottkörteln, de röda blodkropparna och njurarna . Det breda spektrum av vävnader där det tillverkas skiljer det från det liknande enzymet alanintransaminas (ALT) som främst finns i levern. Nivån av AAT i kroppen kan användas som en markör för vävnadssjukdom eller -skada. Dessutom kan AAT- och ALT-nivåerna jämföras för att fastställa om vävnadsskador främst finns i levern.
Struktur
som innehåller (alfahelixer, betasträngar , slingor , vändningar). Asymmetrisk enhet av aspartataminotransferas, med markerad liten och stor domän och PLP-kofaktor (1b4x). Varje underenhet innehåller en motsvarande aktiv plats. Underenheterna är sammankopplade på två ställen: mellan sina stora domäner och mellan de N-terminala resterna och den stora domänen på den andra underenheten. AST:s struktur varierar mycket mellan organismer från E. coli till människor. Dessutom är strukturen på den aktiva platsen mycket välbevarad med en sekvenshomologi på 25 %.
Varje underenhet av homodimern är vidare uppdelad i en liten och en stor domän. Den består av aminosyrorna från N-terminus till rest Pro 48 och från Met 326 till C-terminus. De återstående aminosyrorna utgör den , och den är förbundna med en lång α-helix som består av 32 aminosyror.
Den stora domänen är den plats där AAT:s aktiva plats finns och för att tillgodose detta innehåller kärnan många α/β supersekundära strukturer. Detta står i kontrast till kärnan i den lilla underenheten som bildas av två α-helixer och två β-strängar. I flercelliga organismer finns det en knut vid den 325:e residen som fungerar som ett gångjärn för den lilla domänen, vilket möjliggör de resulterande konformationsförändringar som äger rum vid bindning av hämmare till enzymet.
Som nämnts ovan är den aktiva platsen för AST belägen på den stora domänen av underenheten. Inom den aktiva platsen finns aminorest Lys 258, även känd som den interna aldimin, som binder med kofaktorn pyridoxal 5′-fosfat () och bildar vad som kallas en Schiff-bas. Vid tillsats av ett aminosyrasubstrat bildas en ny Schiff-bas mellan PLP och aminosyran.
Funktion
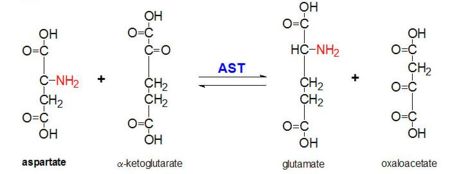
Figur 2: Transaminationsreaktion av L-aspartat och α-ketoglutarat som katalyseras av aspartataminotransferas
AAT katalyserar den reversibla transaminationen av α-aminogruppen från L-aspartat till α-ketoglutarat som bildar oxaloacetat och glutamat. Denna reaktivitet är lägre i E.coli än i högre eukaryoter och har en bredare substratspecificitet. Reaktionen sker dock på samma sätt. Vid införande av ett aminosyrasubstrat bildas en ny Schiff-bas mellan det och PLP-kofaktorn. Detta leder till att aminosyran förlorar ett väte och bildar en quinoidintermediär, och reprotanering äger rum, vilket resulterar i ett ketimin. Därefter hydrolyseras strukturen och bildar en α-ketosyra och pyridoxaminfosfat. 2-metylaspartat fungerar som en hämmare av AAT när det bildar en Schiif-bas med PLP-kofaktorn, snarare än aspartat. Detta resulterar i att processen stannar i steget före alfaproteinets eliminering.
Denna reaktion är väsentlig för att upprätthålla homeostasen i organismer. De fyra olika molekyler som kan bildas som ett resultat av denna transanimering (oxaloacetat, α-ketoglutarat, aspartat, L-glutamat) är kritiska för ett antal metaboliska processer. Oxaloacetat och α-ketoglutarat spelar en kritisk roll i Krebscykeln, olika former av aspartat är viktiga molekyler i ureacykeln och deltar i glukoneogenesen, och glutamat är en viktig molekyl i metaboliska vägar som är förknippade med minnet.
Kliniska tillämpningar
Nivåerna av AAT i kroppen är tecken på vävnadsskador och sjukdomar. Normalt finns AAT i minimala mängder i blodet, men när de organ som nämns ovan skadas frigörs AAT i blodet. Mängden som frigörs står i proportion till nivån på den uppkomna skadan. Det har visat sig att AAT-nivåerna stiger avsevärt inom sex timmar efter den första vävnadsnedbrytningen och kan förbli förhöjda i upp till fyra dagar. När AAT-nivåerna jämförs med nivåerna av andra enzymer kan läkare använda dem för att fastställa var i kroppen skadan har inträffat. Jämförelser med ALT har visat sig vara särskilt användbara för att identifiera leverskador som cirros och hepatit. Under normala förhållanden är AAT-nivåerna hos män 6-34 IU/L och hos kvinnor 8-40 IU/L.
3D-strukturer av aspartataminotransferas
Aspartataminotransferas 3D-strukturer
.