Allmänna egenskaper hos salter
Några av de karakteristiska egenskaperna hos salter är:
- Smält- och kokpunkter: Salter är mestadels fasta ämnen som smälter såväl som kokar vid höga temperaturer.
- Löslighet i vatten: Salter är i allmänhet lösliga i vatten. Till exempel är natriumklorid, kaliumsulfat, aluminiumnitrat, ammoniumkarbonat etc. lösliga salter medan silverklorid, blyklorid, kopparkarbonat etc. är olösliga i vatten.
- Kristalliseringsvatten: Generellt sett finns salter som kristaller med vattenmolekyler närvarande i dem. Detta vatten kallas kristalliseringsvatten och sådana salter kallas hydratiserade salter.
En kopparsulfatkristall har till exempel fem vattenmolekyler för varje kopparsulfatmolekyl. Detta skrivs som CuSO4.5H2O. Detta kristalliseringsvatten ger kristallen dess form. Det ger också färg åt vissa kristaller. Vid upphettning förlorar hydratiserade salter sitt kristalliseringsvatten och som ett resultat av detta förlorar kristallerna sin form och färg och förändras till en pulverformig substans.
De hydratiserade salter som har förlorat sitt kristalliseringsvatten kallas för vattenfria salter.
När hydratiserat kopparsulfat upphettas avger det vattenmolekyler för att bilda vitt pulverformigt vattenfritt kopparsulfat. Vid tillsats av vatten kan detta ämne omvandlas tillbaka till en hydratiserad kopparsulfatlösning igen.
Människor frågar också
- Klassificering av salter
- Användning av olika salter i det dagliga livet
- Förberedelse av salter
- Beskriv beredning av lösliga och olösliga salter
- Kvalitativ. Analys av salter
- Värmepåverkan på salter
- Test för katjoner och anjoner i vattenlösningar
- Konstruktion av joniska ekvationer med hjälp av metoden för kontinuerlig variation
- Vad är stökiometri och varför används den i kemi?
Allmänna egenskaper hos salter :
1. Reaktion med en syra : När ett salt reagerar med en syra bildas ett annat salt och en syra. När till exempel natriumklorid upphettas med svavelsyra bildas först natriumvätesulfat (vid låg temperatur) och sedan natriumsulfat (vid hög temperatur) och vätekloridgas utvecklas.
2. Reaktion med en bas : Ett salt reagerar med en bas för att producera ett annat salt och en annan bas.
(NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH
3. Reaktion med en metall : Ibland kan en saltlösning reagera med en metall. När till exempel en järnspik doppas i en vattenlösning av kopparsulfat avlagras koppar på spikens yta och den järnhaltiga sulfat som bildas stannar kvar i lösningen.
CuSO4 + Fe → FeSO4 + Cu
Denna reaktion visar att järn är mer reaktivt än koppar.
En mer reaktiv metall kan alltså tränga undan en mindre reaktiv metall från en lösning av dess salt.
4. Salts beteende gentemot vatten :
När ett salt löses upp i vatten kan lösningen vara neutral, sur eller alkalisk. Detta beror på vilken typ av salt som används.
(i) Ett normalt salt som härrör från en stark syra och en stark bas ger en neutral lösning. Exempelvis är vattenlösningar av NaCl och K2SO4 neutrala mot litmus.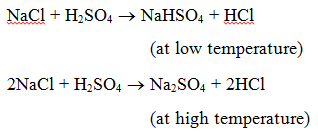
(ii) Ett normalt salt som härrör från en svag syra och en stark bas ger en alkalisk lösning. Exempelvis är vattenlösningar av både natriumkarbonat (Na2CO3) och natriumacetat (CH3COONa) alkaliska.
Na2CO3 + 2H2O → 2NaOH + CO2 + H2O
CH3COONa + H2O → CH3COOH + NaOH
(iii) Ett salt som härstammar från en stark syra och en svag bas ger en sur lösning. Till exempel ger både aluminiumklorid (AlCl3) och ammoniumklorid (NH4Cl) sura vattenlösningar.
AlCl3 + 3H2O → Al(OH)3 + 3HCl
NH4Cl + H2O → NH4OH + HCl
(iv) Lösningar av sura salter är sura mot lakritspapper, dvs. dessa lösningar gör blått lakritspapper rött. Till exempel blir en lösning av natriumhydrogensulfat (NaHSO4) blått lackmuspapper rött.
Natriumvätekarbonat (NaHCO3)-lösning är däremot svagt alkalisk.