Lärandemål
- Att identifiera och namnge enkla (rätkedjiga) alkaner med givna formler och att skriva formler för rätkedjiga alkaner med givna namn.
Vi börjar vår studie av organisk kemi med kolvätena, de enklaste organiska föreningarna, som endast består av kol- och väteatomer. Som vi noterade finns det flera olika typer av kolväten. De skiljer sig åt genom de typer av bindningar mellan kolatomerna och de egenskaper som följer av dessa bindningar. Kolväten med endast enkla bindningar mellan kol och kol (C-C) och som existerar som en kontinuerlig kedja av kolatomer som också är bundna till väteatomer kallas alkaner (eller mättade kolväten). Mättad betyder i detta fall att varje kolatom är bunden till fyra andra atomer (väte eller kol) – så många som möjligt; det finns inga dubbel- eller trippelbindningar i molekylerna.
Ordet mättade har samma betydelse för kolväten som för kostfetter och -oljor: molekylen har inga dubbelbindningar från kol till kol (C=C).
Vi har tidigare presenterat de tre enklaste alkanerna – metan (CH4), etan (C2H6) och propan (C3H8) – och de visas igen i figur \(\PageIndex{1}\).
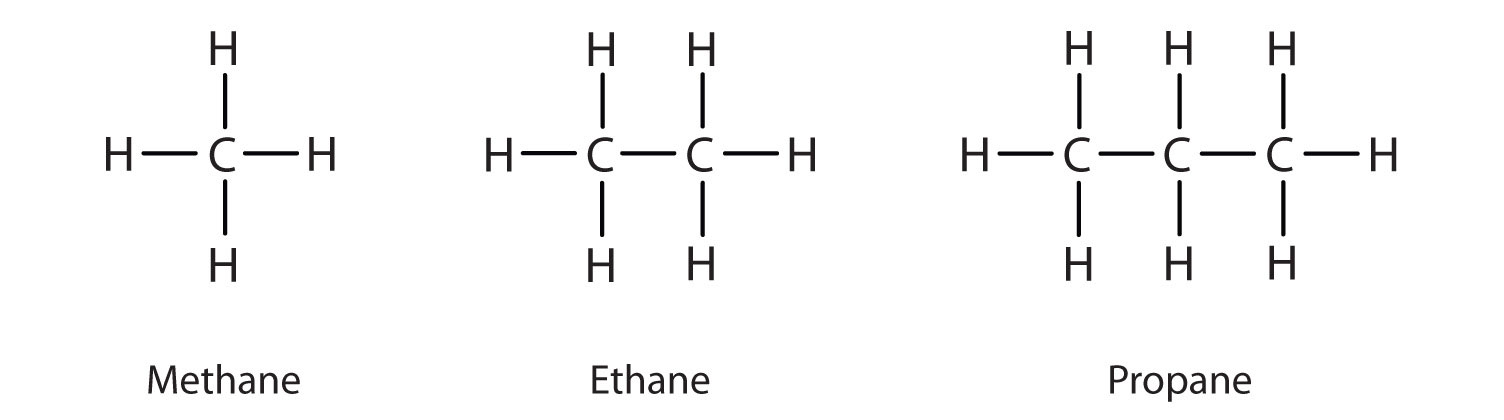
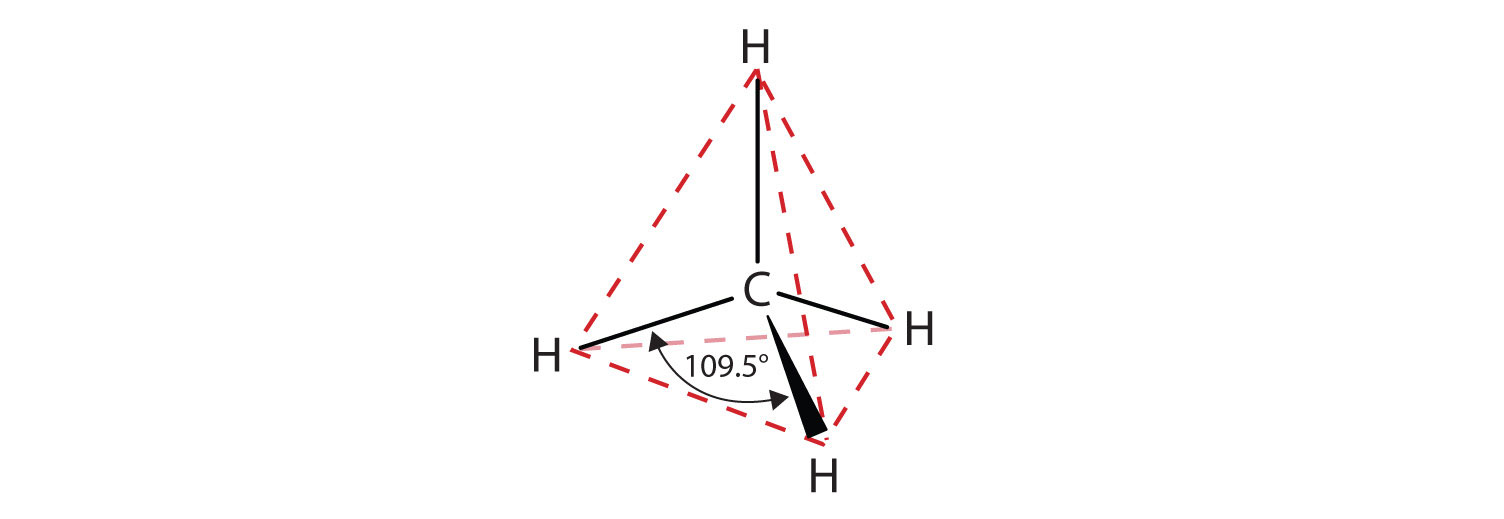
De platta representationer som visas ger inte en korrekt bild av bindningsvinklar eller molekylär geometri. Metan har en tetraederform som kemister ofta avbildar med kilar som anger bindningar som kommer ut mot dig och streckade linjer som anger bindningar som går tillbaka bort från dig. En vanlig heldragen linje anger en bindning i sidans plan. Kom ihåg att VSEPR-teorin korrekt förutsäger en tetraederform för metanmolekylen (Figur \(\PageIndex{2}\)).
Metan (CH4), etan (C2H6) och propan (C3H8) är början på en serie av föreningar där två medlemmar i en sekvens skiljer sig åt med en kolatom och två väteatomer – det vill säga en CH2-enhet. De tio första medlemmarna i denna serie anges i tabell \(\PageIndex{1}\).
| Namn | Molekylformel (CnH2n + 2) | Kondenserad strukturformel | Antal av Möjliga isomerer | |
|---|---|---|---|---|
| metan | CH4 | CH4 | CH4 | – |
| metan | C2H6 | CH3CH3CH3 | – | |
| propan | C3H8 | CH3CH2CH3 | – | |
| butan | C4H10 | CH3CH2CH2CH3 | 2 | |
| pentan | C5H12 | CH3CH2CH2CH2CH2CH3 | 3 | |
| hexan | C6H14 | CH3CH2CH2CH2CH2CH2CH3 | 5 | |
| heptan | C7H16 | CH3CH2CH2CH2CH2CH2CH2CH3 | 9 | |
| oktan | C8H18 | CH3CH3CH2CH2CH2CH2CH2CH2CH2CH2CH3 | 18 | |
| nonan | C9H20 | CH3CH3CH2CH2CH2CH2CH2CH2CH2CH2CH3 | 35 | |
| decan | C10H22 | CH3CH2CH2CH2CH2CH2CH2CH2CH2CH2CH3 | 75 |
Observera serien i figur \(\PageIndex{3}\). Sekvensen börjar med C3H8, och en CH2-enhet läggs till i varje steg uppåt i serien. Varje familj av föreningar där intilliggande medlemmar skiljer sig från varandra med en bestämd faktor (här en CH2-grupp) kallas en homolog serie. Medlemmarna i en sådan serie, som kallas homologer, har egenskaper som varierar på ett regelbundet och förutsägbart sätt. Homologiprincipen ger organisation åt den organiska kemin på ungefär samma sätt som det periodiska systemet ger organisation åt den oorganiska kemin. I stället för en förvirrande mängd enskilda kolföreningar kan vi studera några medlemmar i en homolog serie och från dem härleda några av egenskaperna hos andra föreningar i serien.
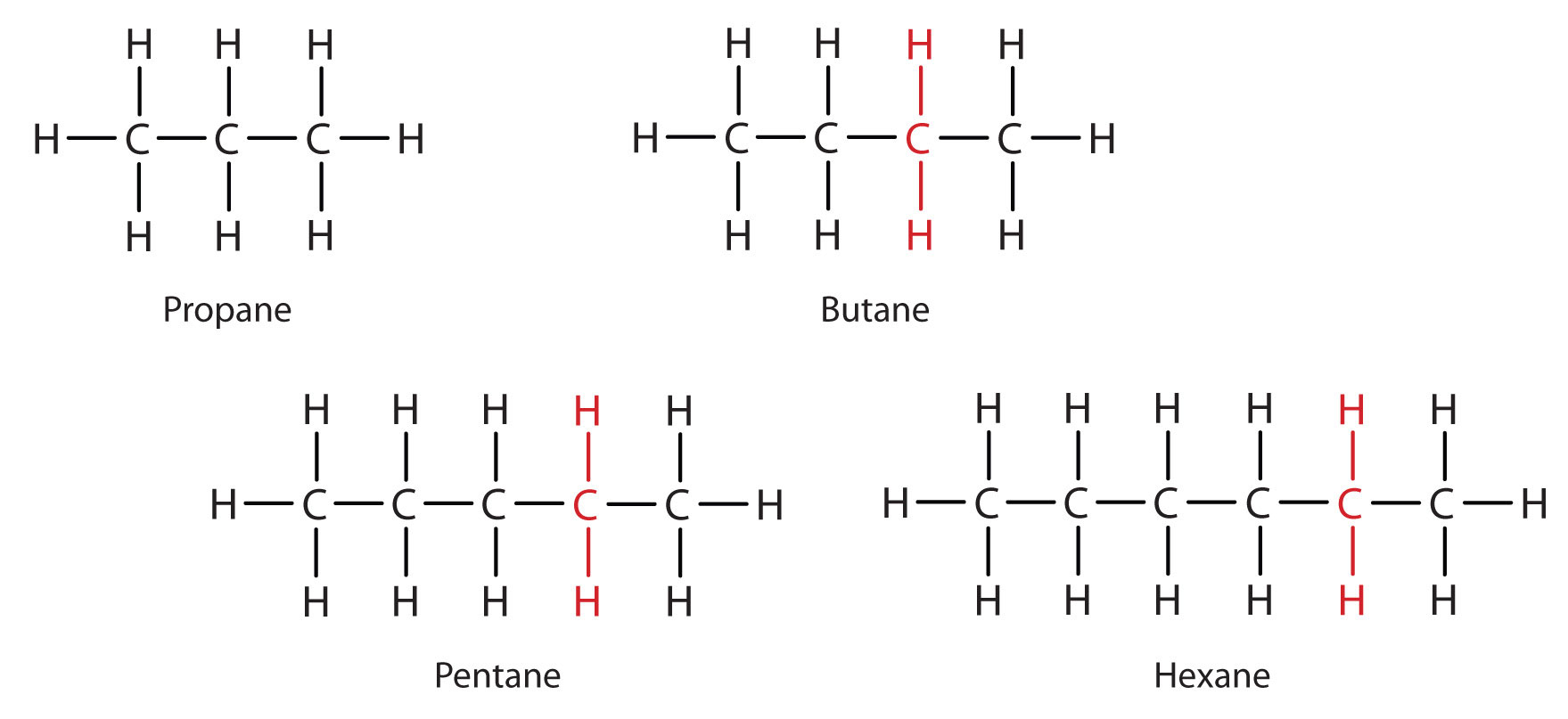
Principen om homologi gör att vi kan skriva en allmän formel för alkaner: CnH2n + 2. Med hjälp av denna formel kan vi skriva en molekylformel för varje alkan med ett givet antal kolatomer. Till exempel har en alkan med åtta kolatomer molekylformeln C8H(2 × 8) + 2 = C8H18.
Nyckelinformation
- Enkla alkaner existerar som homologa serier, där intilliggande medlemmar skiljer sig åt med en CH2-enhet.