Den kemiska reaktionsbilden
I det här kapitlet kommer vi att lära oss mer om några reaktioner där de viktigaste stegen innebär att enstaka elektroner flyttas. Du kanske minns från långt tillbaka i avsnitt 6.1A att rörelsen av en enda elektron avbildas av en ”fiskkrok”-pil med ett enda streck (i motsats till de välbekanta pilarna med dubbla streck som vi har använt genom hela boken för att visa rörelsen av två elektroner).

Enkelelektronmekanismer inbegriper bildning och efterföljande reaktion av fria radikala arter, mycket instabila intermediärer som innehåller en oparad elektron. Vi kommer i det här kapitlet att lära oss hur fria radikaler ofta bildas genom homolytisk klyvning, en händelse där de två elektronerna i en brytande kovalent bindning rör sig i motsatt riktning.

(Däremot innebär i stort sett alla reaktioner som vi hittills har studerat bindningsbrytande händelser där båda elektronerna rör sig i samma riktning: detta kallas heterolytisk klyvning).
Vi kommer också att lära oss att många mekanismer med en enda elektron tar formen av en radikal kedjereaktion, där en radikal orsakar bildandet av en andra radikal, som i sin tur orsakar bildandet av en tredje radikal, och så vidare.
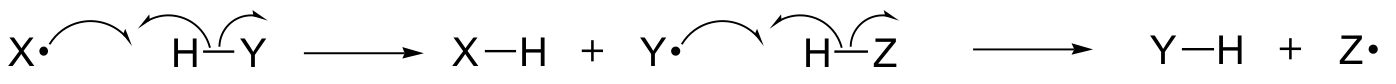
Den höga reaktiviteten hos fria radikala arter och deras förmåga att initiera kedjereaktioner är ofta fördelaktig – vi kommer i det här kapitlet att lära oss om radikala polymeriseringsreaktioner som bildar användbara material såsom plexiglas och polyproylenväv. Vi kommer också att lära oss om radikala reaktioner som är skadliga, t.ex. nedbrytningen av atmosfäriskt ozon genom freon och de oxidativa skador som fria radikaler orsakar på lipider och DNA i våra kroppar. Slutligen kommer vi att se hur vissa enzymer använder bundna metaller för att katalysera höga e
Geometrin och den relativa stabiliteten hos kolradikaler
Som organiska kemister är vi särskilt intresserade av radikala intermediärer där den oparade elektronen befinner sig på en kolatom. Experimentella bevis tyder på att de tre bindningarna i en kolradikal har trigonal planär geometri, och därför anses kolet vara sp2-hybridiserat med den oparade elektronen som ockuperar den lodräta, ohybridiserade 2pzorbitalen. Kontrastera denna bild med karbokations- och karbanjonintermediärer, som båda också är trigonalplanära men vars 2pz-orbitaler innehåller noll respektive två elektroner.

Trenden i stabiliteten hos kolradikalerna är parallell med den hos karbokationerna (avsnitt 8.4B): tertiärradikaler är till exempel mer stabila än sekundärradikaler, följt av primär- och metylradikaler. Detta borde vara intuitivt logiskt, eftersom radikaler, liksom karbocationer, kan anses vara elektronbristfälliga och därmed stabiliseras av de elektrondonerande effekterna av närliggande alkylgrupper. Bensyliska och allyliska radikaler är mer stabila än alkylradikaler på grund av resonanseffekter – en oparad elektron kan flyttas över ett system av konjugerade pi-bindningar. En allylisk radikal kan till exempel beskrivas som ett system av tre parallella 2pz-orbitaler som delar på tre elektroner.
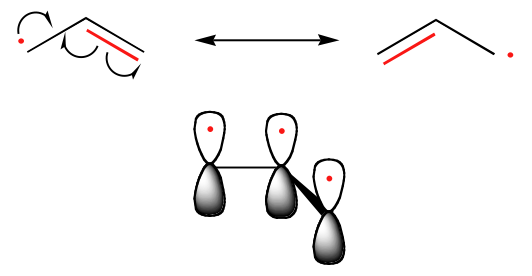
Trender i radikalstabilitet
Allylisk & Bensylisk > 3o > 2o > 1o > Metyl

I denna molekyl förstärks den redan omfattande resonansstabiliseringen ytterligare av kloratomernas förmåga att skydda radikalcentrumet från externa reagenser. Radikalen befinner sig på sätt och vis i en skyddande ”bur”.
Organic Chemistry With a Biological Emphasis av Tim Soderberg (University of Minnesota, Morris)
-
Prof. Steven Farmer (Sonoma State University)
- Layne A. Morsch (University of Illinois Springfield)